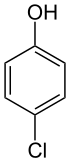
4-Chlorophénol
| 4-Chlorophénol | |
  |
|
| Identification | |
|---|---|
| Nom systématique | 4-chlorophénol |
| Synonymes |
parachlorophénol, p-chlorophénol, 4-CP |
| No CAS | |
| No ECHA | 100.003.094 |
| No RTECS | SK2800000 |
| DrugBank | DB13154 |
| PubChem | 4684 |
| SMILES | |
| InChI | |
| Apparence | aiguilles incolores à grises odeur de type phénol[1] |
| Propriétés chimiques | |
| Formule | C6H5ClO [Isomères] |
| Masse molaire[3] | 128,556 ± 0,007 g/mol C 56,06 %, H 3,92 %, Cl 27,58 %, O 12,45 %, |
| pKa | 9,38[2] |
| Propriétés physiques | |
| T° fusion | 43 °C[1] |
| T° ébullition | 220 °C[1] |
| Solubilité | 27 g·l-1 (eau, 20 °C)[1] |
| Masse volumique | 1,31 g·cm-3 (20 °C)[1] |
| Point d’éclair | 121 °C[1] |
| Pression de vapeur saturante | 13-15 hPa (20 °C) 1,42 hPa (50 °C)[1] |
| Viscosité dynamique | 5 cP (25 °C)[4] |
| Thermochimie | |
| ΔfusH° | 13,600 kJ·mol-1[5] |
| ΔvapH° | 47,04 kJ·mol-1[6] |
| Propriétés optiques | |
| Indice de réfraction | 1,541 9 1,557 9[7] |
| Précautions | |
| SGH[1] | |
| H290, H302, H312, H314, H332 et H411 |
|
| Transport | |
| Écotoxicologie | |
| DL50 | 670 mg·kg-1 (rat, oral)[8] 15 000 mg·kg-1 (rat, dermique)[9] |
| LogP | 2,39[1] |
| Composés apparentés | |
| Isomère(s) | 2-Chlorophénol 3-Chlorophénol |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le 4-chlorophénol est un composé aromatique de formule C6H5ClO (ClC6H4OH). Constitué d'un cycle benzénique substitué par un groupe hydroxyle (phénol) et un atome de chlore en positions 1,4-, c'est l'un des trois isomères du monochlorophénol, le composé para.
Propriétés[modifier | modifier le code]
Le 4-chlorophénol se présente sous la forme d'aiguilles incolores à grises avec une odeur de type phénol[1] désagréable et pénétrante[10]
Il est faiblement soluble dans l'eau (27,7 g·l-1[1]) et également plus dense (1,31)[1]. Il est en revanche très soluble dans l'éthanol, l'éther, le chloroforme et le benzène[7], et soluble en milieu alcalin[11].
Les aiguilles fondent vers 43 °C, et la forme liquide bout vers 224 °C[1]. Le 4-chlorophénol se décompose quand il et chauffé, produisant du chlorure d'hydrogène[12], du phosgène et des dibenzodioxines polychlorées[1].
Le composé est combustible (point d'éclair de 120 °C, coupelle fermée[1]) mais peu inflammable[1].
Avec une pKA de 9,31[2], il est très légèrement plus acide que le phénol (9,99[2]) ; ceci s'explique par l'effet -I du chlore qui stabilise la forme anionique phénolate, mais du fait de sa position opposée au groupe hydroxyle sur le cycle, cet effet est plus faible que pour les isomères méta (9,08) et ortho (8,48).
Le 4-chlorophénol présente un risque d'explosion au contact d'oxydants forts, et réagit dangereusement avec les réducteurs, les bases fortes (formation de dihydrogène), et les hydrures[1].
Il présente des risques aigus (forte irritation et effets corrosifs sur les muqueuses et la peau, risque de lésions graves des yeux et des voies respiratoires, troubles du système nerveux central) ou chroniques (irritation des yeux, des voies respiratoires et de la peau) pour la santé. Les principales sources d'exposition sont les voies respiratoires et par contact avec la peau. Les chlorophénols sont particulièrement facilement absorbés lorsqu'ils sont présents sous une forme non-ionisée, mais l'expérience de la manipulation professionnelle indique que le contact cutané, même avec les sels de chlorophénols, peut être une voie d'absorption importante[1].
Synthèse[modifier | modifier le code]
Chloration du phénol[modifier | modifier le code]
Du fait de l'effet orienteur ortho-para du groupe hydroxyle, le 4-chlorophénol peut être obtenu directement par chloration du phénol. La chloration du phénol fondu par le dichlore produit un mélange des composés ortho et para dans un ratio d'environ 35/65, qui ne dépend guère de la température. Le ratio entre les deux isomères dépend avant tout du réactif de chloration et du milieu réactionnel. Un solvant polaire tel que l'acétonitrile ou le nitrobenzène favorisera la production du 4-chlorophénol, tout comme l'utilisation de chlorure de sulfuryle comme agent chlorant[13],[14].
Autres[modifier | modifier le code]
Le 4-chlorophénol peut aussi être produit par diazotation de la 4-chloroaniline en son sel de diazonium, puis réaction avec l'oxyde de cuivre(I) (réaction de Sandmeyer)[15],[16], ou une variante de cette réaction à partir du p-nitrosophénol[16]. Il peut enfin être produit par réduction sélective de chlorobromophénols[16].
Utilisation[modifier | modifier le code]
Synthèses organiques[modifier | modifier le code]
Le 4-chlorophénol est avant tout un intermédiaire dans la production d'autres composés, comme des colorants, des médicaments ou des produits phytosanitaires[17].,
Parmi les produits dont il participe à la synthèse, on peut citer, le 2,4-dichlorophénol[18] (autre intermédiaire de synthèse, biocide), le 4-chlorophénol-o-crésol[18] (germicide), le chlorofénizon[19] (acaricide), la phosacétine[19] (rodenticide), le dichlorophène[18] (pesticide), le triadimefon (en)[18] (fongicide), la climbazole (en) [20] (antifongique topique), le difénoconazole[20] (fongicide), le profoxydime[20] (herbicide), le 2-benzyl-4-chlorophénol[21] (biocide) et le clofibrate[21] (médicament hypolipémiant).
Il fut autrefois produit en grande quantité comme précurseur de l'hydroquinone[22]. Il sert également dans la production de colorants d'anthraquinone, comme la quinizarine[21]. Il est un précurseur classique de cette dernière, par réaction avec l'anhydride phtalique, puis hydrolyse du chlorure[23],[24].
Autres utilisations[modifier | modifier le code]
Le 4-chlorophénol est solvant sélectif dans le raffinage d'huiles minérales[19],[17]. Il est aussi utilisé comme biocide dans certains produits désinfectants ménagers, hospitaliers ou agricoles[7] et même stérilisateur de sol[25]. Il est également utilisé comme agent antibactérien local dans la thérapie du canal radiculaire et comme antiseptique topique dans certaines pommades[26], notamment en médecine vétérinaire (pour le chat)[27],[25]. Il sert enfin de dénaturant pour alcool[19].
Résidu[modifier | modifier le code]
Le 4-chlorophénol est connu comme résidu de l'utilisation du triadiménol (de)[28].
Notes et références[modifier | modifier le code]
- Entrée « 4-Chlorophenol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Muller F et al; Ullmann's Encyclopedia of Industrial Chemistry. 7th ed. (2005). NY, NY: John Wiley & Sons; Chlorophenols. Online Posting Date: June 15, 2000.
- Yaws, C.L., Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety and Health Related Properties for Organic and Inorganic Chemicals. McGraw-Hill, New York, NY 1999., p. 142
- Yaws, C.L., Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety and Health Related Properties for Organic and Inorganic Chemicals. McGraw-Hill, New York, NY 1999., p. 118
- O'Neil, M.J. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck and Co., Inc., 2006., p. 356
- Federation Proceedings, Federation of American Societies for Experimental Biology. Vol. 2, Pg. 76, 1943
- HYSAAV. Vol. 29(10), Pg. 37, 1964
- Lewis, R.J. Sr.; Hawley's Condensed Chemical Dictionary 14th Edition. John Wiley & Sons, Inc. New York, NY 2001., p. 257
- Lide, D.R. CRC Handbook of Chemistry and Physics 86TH Edition 2005-2006. CRC Press, Taylor & Francis, Boca Raton, FL 2005, p. 3-110
- Lewis, R.J. Sax's Dangerous Properties of Industrial Materials. 9th ed. Volumes 1-3. New York, NY: Van Nostrand Reinhold, 1996, p. 803
- Ullmann's Encyclopedia of Industrial Chemistry. 6th ed.Vol 1: Federal Republic of Germany: Wiley-VCH Verlag GmbH & Co. 2003 to Present, p. V8 387 (2003)
- Ashford, R.D. Ashford's Dictionary of Industrial Chemicals. London, England: Wavelength Publications Ltd., 1994., p. 208
- Lewis, R.J., Sr (Ed.). Hawley's Condensed Chemical Dictionary. 12th ed. New York, NY: Van Nostrand Rheinhold Co., 1993, p. 270
- The Merck Index. 10th ed. Rahway, New Jersey: Merck Co., Inc., 1983., p. 302
- Lewis, R.J. Sr.; Hawley's Condensed Chemical Dictionary 14th Edition. John Wiley & Sons, Inc. New York, NY 2001., p. 270
- USEPA; Ambient Water Quality Criteria Doc: Chlorinated Phenols p.A-5 (1980) EPA 440/5-80-032
- Hazardous Substances Data Bank (HSDB)
- (en) Schollee, Jennifer; Schymanski, Emma; Stravs, Michael; Gulde, Rebekka; Thomaidis, Nikolaos; Hollender, Juliane, Parent-Transformation Product Pairs from Eawag (DOI 10.1007/s13361-017-1797-6)
- Desmurs JR et al; Kirk-Othmer Encyclopedia of Chemical Technology. (2005). NY, NY: John Wiley & Sons; Chlorophenols. Online Posting Date: December 4, 2000.
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a07_001.pub2), « Chlorophenols »
- L. A. Bigelow et H. H. Reynolds, « Quinizarin », Org. Synth., vol. 6, , p. 78 (DOI 10.15227/orgsyn.006.0078)
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a02_355), « Anthraquinone Dyes and Intermediates »
- Rossoff, I.S. Handbook of Veterinary Drugs. New York: Springer Publishing Company, 1974., p. 106
- (en) « Parachlorophenol », sur DrugBank
- Budavari, S. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck and Co., Inc., 1996., p. 359
- Swiss Pesticides and Metabolites from Kiefer et al 2019 (DOI 10.1016/j.watres.2019.114972)







