Résistance systémique acquise
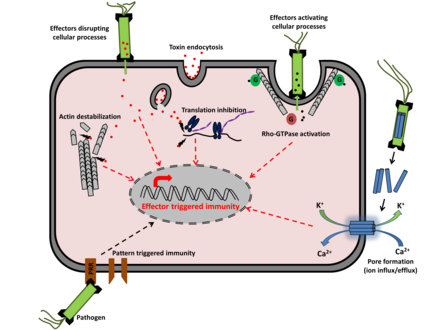
En pathologie végétale, la résistance systémique acquise (RSA, ou SAR, acronyme de Systemic acquired resistance en anglais) désigne une réponse immunitaire, puissante et généralisée à la plante entière, induite par une infection ou agression localisée par un agent pathogène (bactérie, virus, champignon...). La plante est ainsi mieux protégée dans le temps d'une infection ultérieure[4] ; une plante infectée par un pathogène lui sera ensuite plus résistante, mais résistera aussi à d’autres souches du pathogène, voire à des espèces apparentées[5]. Cette résistance des plantes aux maladies est un atout important de sélection adaptative[6].
La RSA peut également être déclenchée par des molécules chimiques ou des agents non pathogènes, ce qui a conduit à imaginer et tester des traitements de protection des cultures par des « inducteurs » de RSA comme alternative aux traitements à l'aide de pesticides [7].
Elle est analogue au système immunitaire inné chez les animaux. On a démontré que la résistance systémique acquise chez les plantes et l'immunité innée chez les animaux peuvent être en tout ou partie conservées par l'évolution d'une génération à l'autre.
Histoire scientifique

Ce mécanisme, probablement depuis longtemps pressenti par certains jardiniers et agriculteurs, est un phénomène bien décrit dans la Nature[10], scientifiquement documenté dès la fin des années 1930[11] mais le mécanisme n'en était pas compris.
Avec les progrès de la biologie moléculaire, de premiers récepteurs végétaux de signatures microbiennes conservées ont été identifiés chez le riz (XA21, 1995)[12] et chez Arabidopsis (FLS2, 2000)[13].
Mécanisme
Cette résistance peut être induite par divers agents pathogènes, en particulier ceux qui causent la nécrose tissulaire, et la résistance observée après induction de la résistance systémique est efficace contre un large spectre d'agents pathogènes, ce qui explique que ce type de résistance est parfois appelée « résistance à large spectre ».
Les plantes n'ont ni globules blancs ni autre cellules immunitaires circulantes connues ; elles utilisent :
- des facteurs solubles (hormones et/ou métabolites...) pouvant circuler via la sève dans toute la plante (ex : parmi les métabolites impliqués figurent l'acide salicylique, le méthyle salicylate, l'acide azélaïque, le glycerol-3-phosphate ou encore le déhydroabiétinal[14],[15],[16]) un acide N-hydroxy-pipécolique (NHP)[17] chez Arabidopsis thaliana. On a aussi montré que la tomate produit aussi un NHP endogène en réponse à un agent pathogène bactérien, et des NHP ont été retrouvés chez des espèces très diverses dans tout le règne végétal ;
- des récepteurs de reconnaissance de modèles, pour reconnaître les signatures microbiennes conservées. Cette reconnaissance déclenche une réponse immunitaire ;
- des récepteurs immunitaires, qui reconnaissent des effecteurs pathogènes très variables (dont protéines de la classe NBS-LRR).
Holmes et al. ont récemment identifié les enzymes d'Arabidopsis thaliana nécessaires à la synthèse du NHP, métabolite induisant le SAR, chez un proche parent du tabac. L'expression locale de ces enzymes dans la feuille de tomate ou un traitement par le NHP de feuille de poivron protège les plantes de l'infection à des sites distants de la plante Chez Arabidopsis le PNH déclenche à lui seul une cascade de réponses immunitaires permettant une résistance à large spectre aux maladies[18].
La résistance systémique acquise est associée à l'induction d'une large gamme de gènes (liée à la pathogenèse), et son activation nécessite l'accumulation d'acide salicylique (AS) endogène. Le signal AS induit par le pathogène active une voie de transduction du signal moléculaire qui est identifiée par un gène appelé NIM1, NPR1 ou SAI1 (trois noms pour le même gène) dans le système génétique de la plante-modèle Arabidopsis thaliana[18].
La résistance systémique acquise a été observée chez de nombreuses plantes à fleurs, y compris des espèces de dicotylédones et de monocotylédones. Elle peut être activée chez le maïs, cependant, une substance commerciale largement adaptée comme le Benzothiadiazole peut ne pas être efficace contre P. sorghi, agent de la rouille commune[19].
Le PNH est dérivé de la lysine. Sa voie de biosynthèse a été associé trois enzymes (protéines) impliqués dans la réponse immunitaire végétale[20],[21],[9],[8],[22],[23]).
Enjeux
La résistance systémique acquise (RSA) est importante pour les plantes elles-mêmes, tant pour la résistance aux maladies que pour la récupération après que ces maladies se sont déclarées. Indirectement elle a une importance pour les réseaux trophiques et les écosystèmes.
Certaines espèces de plantes sauvages montrent des capacités étonnantes de défense contre les maladies, de détection des d’agents pathogènes ou déprédateurs et/ou de signalisation immunitaire et la production d’antimicrobiens.
Faire passer ces capacités d’une famille de plantes à d’autres, par croisement contrôlé ou par génie génétique a depuis le milieu des années 1980 fait l’objet de nombreuses expériences (transfert de gènes de récepteurs immunitaires végétaux d’une famille de plantes à une autre pour en étendre la capacité « native » de détection d’agents pathogènes)[24]. Ceci a conduit à créer des lignées plus résistante à un large spectre de pathogènes, chez des espèces cultivées et domestiquées qui avaient été antérieurement sélectionnées pour d’autres critères et qui n’ont jamais eu ou qui ont perdu cette capacité lors de la domestication ;
l’immunité végétale intéresse l’industrie du génie génétique qui cherche, par la transgenèse, à transférer à des espèces cultivées des gènes favorisant la résistance aux phytopathogènes [24], voire à d’autres facteurs de stress (non biologiques)[18].
Par ce biais en croisant des espèces on espère mieux comprendre et améliorer l'immunité végétale pour l'utilier dans l'agriculture, la sylviculture et le jardinage, par exemple en créant des plantes cultivées produisant du NHP de manière constitutive, ou sous le contrôle d'un système inductible pour renforcer les défenses endogènes, et ainsi améliorer la productivité agricole avec moins de pesticides ; un risque étant toutefois que les phytophathogènes s'adaptent à ces solutions si elles sont intensivement utilisées.
Chez la tomate on a récemment[18] réussi à provoquer l'expression locale et distante de gènes impliqués dans cette immunité (dans les feuilles) - même en l’absence de pathogène - ce qui suggère que le trait de résistance systémique acquise peut être modifié pour améliorer la capacité endogène d'une plante cultivée à réagir plus rapidement et plus efficacement aux pathogènes[18].
Notes et références
- PAMPs-triggered immunity ou immunité déclenchée par les PAMPs.
- Effector-triggered immunity ou immunité déclenchée par les effecteurs (en).
- Luciano Paolozzi, Jean-Claude Liébart, Matthieu Arlat, Michel Dion, Harivony Rakotoarivonina, Introduction à la microbiologie. Microbiologie fondamentale et appliquée, Dunod, (lire en ligne), p. 183
- C. M. J. Pieterse, A. Leon-Reyes, S. Van der Ent, S. C. M. Van Wees (2009) Networking by small-molecule hormones in plant immunity. Nat. Chem. Biol. 5, 308–316
- L. Sticher, B. Mauch-Mani, J. P. Metraux (1997) Systemic acquired resistance. Annu. Rev. Phytopathol. 35, 235–270
- Shah J &,Zeier J (2013), Long-distance communication and signal amplification in systemic acquired resistance. Front. Plant Sci. 4, 30.
- Janice LeBoeuf, « La résistance systémique acquise - De quoi s'agit-il ? », ministère de l’Agriculture et de l'Alimentation - Ontario (Omafra), (consulté le ).
- M. Hartmann, T. Zeier, F. Berndorff, V. Reichel-Deland, D. Kim, M. Hohmann, N. Scholten, S. Schuck, A. Brautigam, T. Holzel, C. Ganter, J. Zeier, Flavin Monooxygenase-Generated N-Hydroxypipecolic Acid is a Critical Element of Plant Systemic Immunity. Cell 173, 456–459.e16 (2018).
- ChenY.C & al. (2018) N-hydroxy-pipecolic acid is a mobile metabolite that induces systemic disease resistance in Arabidopsis. Proc. Natl. Acad. Sci. U.S.A. 115, E4920–E4929 ()
- Spoel S.H & Dong X (2012) How do plants achieve immunity? Defence without specialized immune cells. Nat. Rev. Immunol. 12, 89–100.
- Chester K.S (1933) The problem of acquired physiological immunity in plants. Q. Rev. Biol. 8, 275–324
- (en) W.Y. Song et al., « A receptor kinase-like protein encoded by the rice disease resistance gene, XA21 », Science, vol. 270, no 5243, , p. 1804–1806 (PMID 8525370, DOI 10.1126/science.270.5243.1804).
- (en) Gomez-Gomez, L. et al., « FLS2: an LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis », Molecular Cell, vol. 5, no 6, , p. 1003–1011 (PMID 10911994, DOI 10.1016/S1097-2765(00)80265-8)
- Shah J & Zeier J (2013) ‘Long-distance communication and signal amplification in systemic acquired resistance’. Front. Plant Sci. 4, 30.
- Fu Z.Q & Dong x (2013) « Systemic acquired resistance: Turning local infection into global defense ». Annu. Rev. Plant Biol. 64, 839–863
- FunZQ & Dong X (2013) Systemic acquired resistance: Turning local infection into global defense. Annu. Rev. Plant Biol. 64, 839–863
- Hartmann M, Zeier J (2018) l-lysine metabolism to N-hydroxypipecolic acid: An integral immune-activating pathway in plants. Plant J. 96, 5–21
- Holmes EC & al. (2019) « An engineered pathway for N-hydroxy-pipecolic acid synthesis enhances systemic acquired resistance in tomato » ; Science Signaling 22 Oct 2019:Vol. 12, Issue 604, eaay3066 | DOI: 10.1126/scisignal.aay3066
- (en) « Induction of Systemic Acquired Resistance to Puccinia sorghi in Corn » (consulté le )
- H. Návarová, F. Bernsdorff, A.-C. Döring, J. Zeier, Pipecolic Acid, an Endogenous Mediator of Defense Amplification and Priming, Is a Critical Regulator of Inducible Plant Immunity. Plant Cell 24, 5123–5141 (2012).
- Ding P & al. (2016) Characterization of a pipecolic acid biosynthesis pathway required for systemic acquired resistance. Plant Cell 28, 2603–2615
- Mishina T.E & Zeier J (2006) The arabidopsis flavin-dependent monooxygenase FMO1 Is an essential component of biologically induced systemic acquired resistance. Plant Physiol. 141, 1666–1675
- Bartsch M & al. () Salicylic acid-independent ENHANCED DISEASE SUSCEPTIBILITY1 signaling in Arabidopsis immunity and cell death is regulated by the monooxygenase FMO1 and the nudix hydrolase NUDT7. Plant Cell 18, 1038–1051 (2006)
- L. Rodriguez-Moreno, Y. Song, B. P. H. J. Thomma (2017), Transfer and engineering of immune receptors to improve recognition capacities in crops. Curr. Opin. Plant Biol. 38, 42–49
Voir aussi
Articles connexes
- Résistance des plantes aux maladies
- Réponse hypersensible
- Acide salicylique
- Pathologie végétale
- Vaccin
Liens externes
- (en) Exploiting Plants' Protective Proteins (Utilisation des protéines protectrices des plantes).
