Histidine décarboxylase
Histidine décarboxylase
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | PLP (chez l'animal) ou pyruvate (bactéries) |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
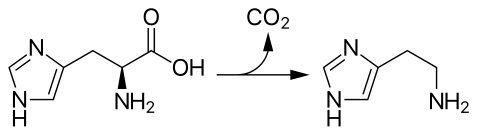
L'histidine décarboxylase (HDC) est une lyase qui catalyse la réaction[1],[2],[3] :
Cette enzyme homodimérique est très spécifique de son substrat, l'histidine. Elle est présente chez les animaux, les plantes et de nombreuses bactéries. Elle utilise le phosphate de pyridoxal, forme biologique de la vitamine B6, comme cofacteur. Elle produit de l'histamine, une amine biogénique qui module de nombreux processus physiologiques tels que la neurotransmission, la sécrétion d'acide gastrique, et le tonus des muscles lisses. La catéchine et la tritoqualine sont des inhibiteurs de l'histidine décarboxylase et agissent donc comme antihistaminiques.
Notes et références[modifier | modifier le code]
- (en) Helen R. P. Epps, « Studies on bacterial amino-acid decarboxylases. 4. l(—)-histidine decarboxylase from Cl. welchii Type A », Biochemical Journal, vol. 39, no 1, , p. 42-46 (PMID 16747851, PMCID 1258146, lire en ligne)
- (en) W. Dixon. Riley et Esmond E. Snell, « Histidine decarboxylase of Lactobacillus 30a. IV. The presence of covalently bound pyruvate as the prosthetic group », Biochemistry, vol. 7, no 10, , p. 3520-3528 (PMID 5681461, DOI 10.1021/bi00850a029, lire en ligne)
- (en) J. Rosenthaler, Beverly M. Guirard, G. W. Chang et Esmond E. Snell, « Purification and properties of histidine decarboxylase from Lactobacillus 30a », Proceedings of the National Academy of Sciences of the United States of America, vol. 54, no 1, , p. 152-158 (PMID 5216347, PMCID 285813, DOI 10.1073/pnas.54.1.152, lire en ligne)