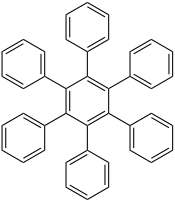
Hexaphénylbenzène
| Hexaphénylbenzène | |
| |
| Structure de l'hexaphénylbenzène | |
| Identification | |
|---|---|
| Nom systématique | 1,2,3,4,5,6-hexakis-phénylbenzène |
| No CAS | |
| No ECHA | 100.012.356 |
| No CE | 213-591-7 |
| PubChem | 70432 |
| SMILES | |
| InChI | |
| Apparence | poudre blanchâtre[1] |
| Propriétés chimiques | |
| Formule | C42H30 |
| Masse molaire[2] | 534,687 6 ± 0,035 7 g/mol C 94,34 %, H 5,66 %, |
| Propriétés physiques | |
| T° fusion | 300 °C[1] 454 à 456 °C[3] |
| Précautions | |
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
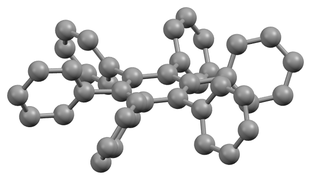
L'hexaphénylbenzène est un composé aromatique de formule chimique C6(C6H5)6. Sa molécule dérive formellement d'un cycle benzénique dont les six atomes d'hydrogène sont substitués chacun par un groupe phényle. Il se présente sous la forme d'une poudre blanche formée de cristaux incolores. Il représente une classe d'hydrocarbures dite d'hexaarylbenzènes, dont l'intérêt est essentiellement théorique[4]. Dans la conformation stable de cette molécule à l'état condensé, le cycle des substituants phényliques est incliné d'environ 65° sur le plan du noyau benzénique pour donner une configuration en hélice[5] ; en phase gazeuse, les cycles des substituants phényliques sont en revanche orthogonaux au plan du noyau benzénique avec de légères oscillations[6].
- Structure tridimensionnelle état solide[5]
-
Vue latérale.
-
Vue de dessus.
On obtient l'hexaphénylbenzène en chauffant de la tétraphénylcyclopentadiénone et du diphénylacétylène dans de la benzophénone ou d'autres solvants à haute température, ce qui fait intervenir une réaction de Diels-Alder pour donner de l'hexaphényldiénone, laquelle donne l'hexaphénylbenzène par élimination d'une molécule de monoxyde de carbone[3] :
-
Préparation de l'hexaphénylbenzène.
De même que le 1,2,3,4-tétraphénylnaphtalène, il se forme également par oligomérisation du diphénylacétylène catalysée par le chrome[7].
Notes et références[modifier | modifier le code]
- « Fiche du composé Hexaphenylbenzene, 98+% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Louis F. Fieser, Chester E. Ramey et V. Boekelheide, « Hexaphenylbenzene », Organic Syntheses, vol. 46, , p. 44 (DOI 10.15227/orgsyn.046.0044, lire en ligne)
- (en) Varun Vij, Vandana Bhalla et Manoj Kumar, « Hexaarylbenzene: Evolution of Properties and Applications of Multitalented Scaffold », Chemical Reviews, vol. 116, no 16, , p. 9565-9627 (PMID 27498592, DOI 10.1021/acs.chemrev.6b00144, lire en ligne)
- (en) J. C. J. Bart, « The crystal structure of a modification of hexaphenylbenzene », Acta Crystallographica Section B, vol. B24, , p. 1277-1287 (DOI 10.1107/S0567740868004176, lire en ligne)
- (en) Devens Gust, « Restricted rotation in hexaarylbenzenes », Journal of the American Chemical Society, vol. 99, no 21, , p. 6980-6982 (DOI 10.1021/ja00463a034, lire en ligne)
- (en) W. Herwig, W. Metlesics et H. Zeiss, « π-Complexes of the Transition Metals. X. Acetylenic π-Complexes of Chromium in Organic Synthesis », Journal of the American Chemical Society, vol. 81, no 23, , p. 6203-6207 (DOI 10.1021/ja01532a024, lire en ligne)