Couplage de Kumada
Un couplage de Kumada ou couplage de Kumada-Corriu est une réaction de couplage croisé de chimie organique entre un réactif de Grignard alkyle ou aryle et un dérivé halogéné aryle ou vinyle catalysé par du nickel ou du palladium. Cette réaction est importante en synthèse organique car elle permet de synthétiser des composés de styrène. Ce type de réaction a été découverte de manière indépendante par deux groupes en 1972.
Développement[modifier | modifier le code]
Cette méthode est basée sur un travail plus ancien effectué par Tamura et Kochi en 1971 sur les couplages de réactifs de Grignard avec des quantités catalytiques d'autres halogénures métalliques que le nickel, comme par exemple l'argent[1]. Les couplages de Grignard stœchiométriques et les homo-couplages de Grignard étaient déjà bien connus avant cette période.
Le premier rapport du groupe de Makoto Kumada[2] décrivait la réaction d'un réactif de Grignard, en l'espèce le bromure de phénylmagnésium, avec un chlorure d'aryle ou de vinyle comme le chlorure de vinyle sur le produit couplé (styrène), catalysé par un chlorure de nickel avec deux ligands dppe (NiCl2dppe2) :
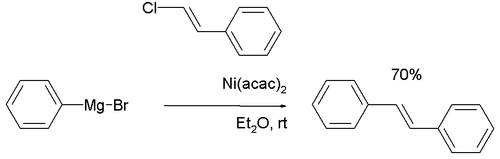
Dans le rapport de 1972 de Corriu[3], le β-bromostyrène réagit avec le bromure de phénylmagnésium pour donner le trans-stilbène dans le diéthyléther avec des catalyseurs nickel comme l'acétylacétonate de nickel (II).
Le palladium fut introduit dans cette chimie en 1975 par Murahashi[4] lorsque le tétrakis(triphénylphosphine)palladium(0) Pd(P(C6H5)3)4 fut décrit comme un catalyseur de la réaction du Z-bromostyrène avec l'iodure de méthylmagnésium pour donner du Z-propenylbenzène. Avec le méthyllithium plus réactif, le catalyseur palladium n'est pas recyclé assez vite et la réaction d'élimination vers l'alcyne prédomine.
Mécanisme de réaction[modifier | modifier le code]
Le mécanisme de réaction pour des catalyseurs Ni(II) est une séquence en plusieurs étapes[5] :
- transmétallation : le catalyseur dihalogénickel réagit avec le composé de Grignard R-Mg-X pour donner un intermédiaire diorganonickel NiR2L2 et un dihalogénickel NiX2.
- élimination réductrice : la réaction de NiR2L2 avec l'organohalogénure R'X donne le produit couplé R-R avec l'organohalogénure de nickel NiR'XL2. Cette étape, comparée au reste de la réaction, est négligeable, le composé au nickel actif étant formé en quantités catalytiques.
- transmétallation : lors de la première étape du cycle catalytique, l'organohalogénure de nickel NiR'XL2 réagit avec un autre équivalent de R-Mg-X afin de donner un mélange de diorganonickel NiRR'L2 et de dihalogénonickel NiX2.
- isomérisation cis-trans avec les substrats trans-dichloroéthylène et chlorure de phénylmagnésium. Le stilbène résultant est enrichi en isomère cis.
- coordination : un nouvel équivalent d'organohalogénure R'-X est ajouté au mélange du complexe dihalogénonickel.
- addition oxydante : le produit R-R' croisé-couplé est produit avec une régénération de l'organohalogénure de nickel NiR'XL2.
Les étapes principales dans le mécanisme pour les catalyseurs Ni(0) et Pd(0) sont l'oxydation additive de l'organohalogénure, la transmétallation du réactif de Grignard et l'élimination réductive.
Champ d'application[modifier | modifier le code]
Le champ d'application de cette réaction a été étendue aux couplages aryle-aryle avec une tolérance accrue aux groupes fonctionnels[6] :
Dans cette réaction particulière le réactif de Grignard est préparé in situ par transmétallation d'un iodure d'aryle par le chlorure d'isopropylmagnésium/chlorure de lithium[7].
Références[modifier | modifier le code]
- (en) J. K. Kochi et M. Tamura, « Mechanism of the silver-catalyzed reaction of Grignard reagents with alkyl halides », J. Am. Chem. Soc., vol. 93, no 6, , p. 1483–1485 (ISSN 0002-7863, DOI 10.1021/ja00735a028).
- (en) Y. Kiso, K. Sumitani et al., « Asymmetric homogeneous hydrosilylation with chiral phosphine-palladium complexes », J. Am. Chem. Soc., vol. 94, no 12, , p. 4373–4374 (ISSN 0002-7863, DOI 10.1021/ja00767a074).
- (en) R. J. P. Corriu et J. P. Masse, « Activation of Grignard reagents by transition-metal complexes. A new and simple synthesis of trans-stilbenes and polyphenyls », J. Chem. Soc., Chem. Commun., no 3, , p. 144 (ISSN 0022-4936, DOI 10.1039/C3972000144A).
- (en) M. Yamamura, I. Moritani et al., « The reaction of σ-vinylpalladium complexes with alkyllithiums. Stereospecific syntheses of olefins from vinyl halides and alkyllithiums », J. Organomet. Chem., vol. 91, no 2, , C39–C42 (ISSN 0022-328X, DOI 10.1016/S0022-328X(00)89636-9).
- (en) L. Kürti et B. Czakó, Strategic applications of organic named reactions in organic synthesis, Academic Press, , 810 p. (ISBN 978-0-12-429785-2, présentation en ligne), p. 258-259.
- (en) R. Martin et S. L. Buchwald, « Pd-Catalyzed Kumada−Corriu Cross-Coupling Reactions at Low Temperatures Allow the Use of Knochel-type Grignard Reagents », J. Am. Chem. Soc., vol. 129, no 13, , p. 3844–3845 (ISSN 0002-7863, DOI 10.1021/ja070830d).
- (en) A. Krasovskiy et P. Knochel, « A LiCl-Mediated Br/Mg Exchange Reaction for the Preparation of Functionalized Aryl- and Heteroarylmagnesium Compounds from Organic Bromides », Angew. Chem. Int. Ed., vol. 43, no 25, , p. 3333-3336 (ISSN 1433-7851, DOI 10.1002/anie.200454084).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Kumada coupling » (voir la liste des auteurs).