Bêta-lactamase
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Zinc |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Les β-lactamases sont une famille d'enzymes (EC 3.5.2.6) responsables de la résistance de certaines bactéries vis-à-vis de certains antibiotiques bêta-lactamine. Parmi ces antibiotiques, on trouve les pénicillines et les céphalosporines. On en retrouve parmi les bactéries à Gram-négatif, mais pas uniquement.
La pénicillinase est une β-lactamase montrant une spécificité de substrat pour les pénicillines. La pénicillinase a été la première β-lactamase à avoir été identifiée. Elle a été isolée pour la première fois par Abraham and Chain en 1940 à partir d'Escherichia coli avant même que la pénicilline ne soit utilisée de manière médicale. La production de pénicillinase par les bactéries s'est alors rapidement répandue, même par les souches qui ne la produisaient pas précédemment grâce au transfert plasmidique d'information génétique entre cellules bactériennes. Des bêta-lactamines résistant à la pénicillinase comme la méthicilline ont alors été développés, mais des résistances contre ces molécules sont également apparues.
Mode d'action
[modifier | modifier le code]Les antibiotiques bêta-lactamine partagent un élément commun dans leur structure moléculaire, un cycle central à quatre atomes, le β-lactame (Voir ampicilline pour un exemple de structure de pénicilline). Les β-lactamases hydrolysent ce cycle, désactivant ainsi les propriétés antibiotiques de la molécule.
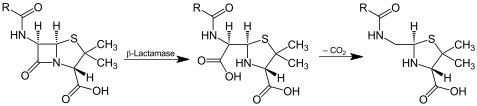
La structure d'une β-lactamase de Streptomyces est donnée dans la PDB[1] (EC 3.5.2.6)
Les antibiotiques bêta-lactamines agissent en bloquant la synthèse du peptidoglycane, constituant de la paroi des bactéries. Leur site d'action se trouve donc à l'extérieur de la membrane bactérienne. Pour cette raison, les bêta-lactamases sont sécrétées à l'extérieur de la cellule par les bactéries pour pouvoir dégrader l'antibiotique avant qu'il ne puisse agir.
Inhibiteur
[modifier | modifier le code]L'acide clavulanique, produit naturel par Streptomyces clavuligerus, est un inhibiteur suicide d'un certain nombre de β-lactamases/pénicillinases. C'est un substrat suicide qui est un dérivé structurel de la pénicilline. Cette ressemblance est suffisante pour lui permettre de se fixer irréversiblement à la β-lactamase, permettant ainsi à l'antibiotique de fonctionner.
Durant un traitement médical, il est parfois administré en association avec des antibiotiques β-lactamines, pour en potentialiser l'action en bloquant l'action des enzymes de résistance.
Démonstration expérimentale de l'effet d'une béta-lactamase et de son inhibiteur
[modifier | modifier le code]Dans deux boîtes de Pétri, sur une gélose de mise en culture bactérienne, nous déposons un disque de papier imprégné d’amoxicilline (AMX) et un disque imprégné d'Augmentin (AMC) contenant de l’acide clavulanique et de l'amoxicilline. Nous ensemençons la première boîte avec la bactérie sensible à AMX (E. coli DH5α) et la deuxième boîte avec la bactérie résistante (E. coli DH5α/pBR322). Ces deux boîtes sont placées sous incubation pendant 48h.
Après incubation, dans la boîte contenant la bactérie sensible, on peut voir un halo autour de chaque disque ce qui signifie que la bactérie n’a pas pu croître dans la zone entourant les deux disques d’antibiotiques. Alors que dans la boîte contenant la bactérie résistante, on ne peut voir qu'un seul petit halo (car la quantité d'acide clavulanique est minime) autour du disque contenant la combinaison AMC.
Classification des béta-lactamases
[modifier | modifier le code]Il existe deux types de classification pour les béta-lactamases[2],[3].
La première, proposée par Ambler en 1980 [4], classe les béta-lactamases selon leur séquence en acides aminés. On y trouve quatre classes : A, B, C et D. Les classes A, C et D regroupent les béta-lactamases de type sérine protéase et la classe B regroupe les béta-lactamases de type métalloprotéase à zinc[5].
Les autres classifications sont des classifications fonctionnelles, qui prennent en compte entre autres la nature des substrats et l'affinité relative pour ces substrats. L'une des plus récentes est la classification de Bush et Jacoby datant de 2009[6] et qui comprend 16 classes différentes.
Notes et références
[modifier | modifier le code]- 1BSG.
- Dalèle Elhani, « Les bêta-lactamases à spectre étendu : le défi s’accentue », Annales de biologie clinique, vol. 70, no 2, , p. 117–140 (ISSN 0003-3898, DOI 10.1684/abc.2012.0686, lire en ligne, consulté le )
- (en) Karen Bush et George A. Jacoby, « Updated Functional Classification of β-Lactamases », Antimicrobial Agents and Chemotherapy, vol. 54, no 3, , p. 969–976 (ISSN 0066-4804 et 1098-6596, PMID 19995920, PMCID PMC2825993, DOI 10.1128/AAC.01009-09, lire en ligne, consulté le )
- (en) Ambler, R.P., « The structure of β-lactamases », Philosophical Transactions of the Royal Society of London. B, Biological Sciences, vol. 289, no 1036, , p. 321–331 (ISSN 0080-4622 et 2054-0280, DOI 10.1098/rstb.1980.0049, lire en ligne, consulté le )
- (en) Barry G. Hall et Miriam Barlow, « Revised Ambler classification of β-lactamases », Journal of Antimicrobial Chemotherapy, vol. 55, no 6, , p. 1050–1051 (ISSN 1460-2091 et 0305-7453, DOI 10.1093/jac/dki130, lire en ligne, consulté le )
- (en) Karen Bush et George A. Jacoby, « Updated Functional Classification of β-Lactamases », Antimicrobial Agents and Chemotherapy, vol. 54, no 3, , p. 969–976 (ISSN 0066-4804 et 1098-6596, PMID 19995920, PMCID PMC2825993, DOI 10.1128/AAC.01009-09, lire en ligne, consulté le )
- Jacoby GA, Munoz-Price LS. The new β-lactamases. N Engl J Med 2005;352:380-91.

