Vératrole
| Vératrole | |||
 Structure du vératrole |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,2-diméthoxybenzène | ||
| Synonymes |
orthodiméthoxybenzène, o-diméthoxybenzène |
||
| No CAS | |||
| No ECHA | 100.001.860 | ||
| No CE | 202-045-3 | ||
| No RTECS | CZ6475000 | ||
| PubChem | 7043 | ||
| ChEBI | 59114 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C8H10O2 [Isomères] |
||
| Masse molaire[1] | 138,163 8 ± 0,007 7 g/mol C 69,54 %, H 7,3 %, O 23,16 %, |
||
| Propriétés physiques | |||
| T° fusion | 15 °C[2] | ||
| T° ébullition | 206 à 207 °C[2] | ||
| Masse volumique | 1,084 g·cm-3[2] à 25 °C | ||
| Point d’éclair | 72 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
| H302 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le vératrole, ou 1,2-diméthoxybenzène, est un composé aromatique de formule chimique C6H4(OCH3)2. Cet éther diméthylique est l'un de trois isomères du diméthoxybenzène, le composé ortho. Il se présente sous la forme d'un liquide incolore à l'odeur agréable, faiblement soluble dans l'eau mais très soluble dans les solvants organiques.
Occurrence[modifier | modifier le code]
Le vératrole est présent dans la nature. Il est notamment biosynthétisé par méthylation du gaïacol par la gaïacol O-méthyltransférase[3]. Le gène de la gaïacol O-méthyltransférase est par ailleurs le premier gène de parfum jamais découvert dans une plante[3]. Le vératrole est un attracteur à insectes[3].
Synthèse[modifier | modifier le code]
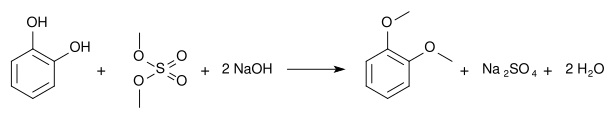
Le vératrole peut être obtenu en traitant du pyrocatéchol avec du sulfate de diméthyle (CH3)2SO4 :
Il peut également être obtenu par décomposition thermique de l'acide vératrique HOOCC6H3(OCH3)2.
Utilisations[modifier | modifier le code]
C'est un précurseur utilisé dans la synthèse organique d'autres composés aromatiques. Relativement riche en électrons, il peut facilement subir une substitution électrophile[4]. Il peut par exemple servir à synthétiser la 3,4-diméthoxyacétophénone (acétovératrone) par acylation de Friedel-Crafts[5] ou est utilisé dans la synthèse de la domipizone[6].
Le vératrole peut être facilement bromé par le NBS pour donner le 4-bromovératrole[7].
Dérivés[modifier | modifier le code]
L'addition d'un autre substituant carboné au vératrole produit une classe de dérivés nommés d'après lui. Le tableau ci-dessous regroupe les plus importants d'entre eux.
–CH2OH –CHO –COOH 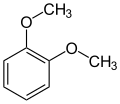


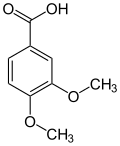
Vératrol Alcool vératrique Vératraldéhyde Acide vératrique
Le vératraldéhyde peut notamment être produit par réaction de Vilsmeier-Haack[8]
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « 1,2-Dimethoxybenzene » (voir la liste des auteurs) et en allemand « Veratrol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 1,2-Dimethoxybenzene ≥ 99%, consultée le 9 octobre 2013.
- Alok K Gupta, Tariq A Akhtar, Alex Widmer, Eran Pichersky et Florian P Schiestl, « Identification of white campion (Silene latifolia) guaiacol O-methyltransferase involved in the biosynthesis of veratrole, a key volatile for pollinator attraction », BMC Plant Biology, vol. 12, , p. 158 (PMID 22937972, PMCID 3492160, DOI 10.1186/1471-2229-12-158)
- Janssen, D. E., 4-Iodoveratrole, Org. Synth., coll. « vol. 4 », , p. 547
- Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, (ISBN 3-335-00343-8), p. 341.
- EP 0129791, (1985); CA, 102, 220886 (synth, pharmacol).
- R. A. B. Bannard et G. Latremouille, « 4-BROMOVERATROLE », Canadian Journal of Chemistry, vol. 31, no 4, , p. 469–469 (ISSN 0008-4042, DOI 10.1139/v53-062)
- Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, (ISBN 3-335-00343-8), p. 345.