Tendances périodiques
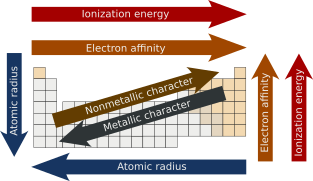
Les tendances périodiques sont des patterns d'évolution de certaines propriétés des éléments à travers le tableau périodique. Ils ont été découverts par le chimiste russe Dmitri Mendeleïev en 1863.
Les tendances principales sont le rayon atomique, l'énergie d'ionisation, l'affinité électronique, l'électronégativité, la valence et le caractère métallique.
Ces tendances donnent une évaluation qualitative des propriétés des éléments. Elles existent en raison de similarités électroniques au sein des groupes et des périodes respectifs des éléments. C'est une illustration de la nature périodique des éléments[1],[2].
Résumé[modifier | modifier le code]
| Propriété périodique | Le long d'une période | En descendant un groupe |
|---|---|---|
| Rayon atomique | Diminue | Augmente |
| Énergie d'ionisation | Augmente | Diminue |
| Affinité électronique | Augmente | Diminue |
| Électronégativité | Augmente | Diminue |
| Valence | Augmente puis diminue | Constant |
| Caractère non métallique | Augmente | Diminue |
| Caractère métallique | Diminue | Augmente |
Rayon atomique[modifier | modifier le code]
Le rayon atomique est une mesure de la taille d'un atome : c'est la distance entre le noyau atomique et l'orbite électronique la plus externe dans un atome. En général, le rayon atomique diminue lorsqu'on se déplace de gauche à droite dans une période. Il augmente lorsqu'on descend d'un groupe.
Dans une période, les électrons de valence se trouvent dans la même couche la plus externe (de nombre quantique principal égal à n). Or en se déplaçant de gauche à droite dans une période, la charge nucléaire effective perçue par les électrons externes est plus grande (voir Règle de Slater), ce qui augmente la force exercée par le noyau sur ces électrons. L'augmentation des forces d'attraction va rapprocher les électrons du noyau et réduire le rayon atomique des éléments.
Lorsqu'on descend dans le groupe, le rayon atomique augmente en raison de l'ajout de nouvelles couches électroniques[3],[4].
Énergie d'ionisation[modifier | modifier le code]
L'énergie d'ionisation est la quantité minimale d'énergie qu'un atome ou un ion gazeux doit absorber pour arracher un électron (de valence), et le sortir de l'influence de la force d'attraction du noyau. On parle de première énergie d'ionisation pour désigner l'énergie nécessaire à arracher le premier électron d'un atome neutre. De même, l'énergie nécessaire pour arracher le nième électron de l'atome neutre est appelée la nième énergie d'ionisation[5].
L'énergie d'ionisation suit une tendance inverse à celle de la taille atomique. En effet, plus le rayon atomique est petit, plus la force d'attraction est puissante et plus il est difficile d'ioniser l'atome.
Ainsi, lorsque l'on se déplace de gauche à droite au sein d'une période du tableau périodique, l'énergie d'ionisation augmente.
Cependant, lorsque l'on descend dans un groupe, l'énergie d'ionisation diminue en raison de l'ajout d'une couche de valence, qui diminue l'attraction du noyau pour les électrons externes[6],[7].
Affinité électronique[modifier | modifier le code]
L'affinité électronique est l'énergie libérée lorsqu'un électron est ajouté à un atome neutre isolé pour former un anion[8].
Au sein d'une période, l'affinité électronique augmente lorsque l'on progresse de gauche à droite. En effet, la charge nucléaire augmente de gauche à droite, alors que la taille atomique diminue. À mesure que la force d'attraction entre le noyau et de les électrons externes est plus puissante, il est plus facile d'ajouter un électron.
Lors de la descende au sein d'un groupe, l'affinité électronique diminuera en même temps que la taille atomique augmente en raison de l'ajout d'une couche de valence, qui diminue l'attraction du noyau pour les électrons externes.
Selon la tendance précédente, le fluor devrait avoir la plus grande affinité électronique mais sa petite taille génère de la répulsion entre les électrons, ce qui donne au chlore l'affinité électronique la plus élevée de la famille des halogènes[9].
Électronégativité[modifier | modifier le code]
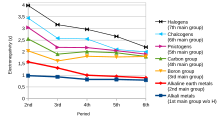
L'électronégativité est la tendance d'un atome dans une molécule à attirer vers lui la paire d'électrons partagée lors de la formation d'une liaison chimique. C'est une propriété sans dimension qui permet de caractériser la nature de la liaison[10]. L'échelle la plus couramment est l'échelle de Pauling conçue par Linus Pauling. Selon cette échelle, le fluor est l'élément le plus électronégatif, tandis que le francium est l'élément le moins électronégatif (le césium si on se limite aux éléments non radioactifs)[11].
En termes de tendance, lorsque l'on se déplace de gauche à droite sur une période du tableau périodique moderne, l'électronégativité augmente car la charge du noyau augmente, ce qui lui permet d'intéragir davantage avec les électrons engagés dans la liaison[12].
Si on descend dans un groupe, l'électronégativité diminue à mesure que la taille atomique augmente en raison de l'ajout d'une couche de valence, diminuant ainsi l'attraction de l'atome pour les électrons.
Cependant, dans le groupe XIII (famille du bore), l'électronégativité diminue du bore à l'aluminium, puis augmente à mesure qu'on descend dans le reste du groupe. Cela est dû au mauvais blindage des électrons d et f internes, ce qui va augmenter la charge nucléaire effective. En conséquence, la force d'attraction du noyau pour les électrons augmente, ainsi que l'électronégativité entre l'aluminium et le thallium[13],[14].
Valence[modifier | modifier le code]
La valence d'un élément est le nombre de liaisons qu'un atome peut former à partir de sa configuration électronique afin d'obtenir une configuration électronique stable. C'est la mesure de la capacité d'un élément à former des liaisons et des composés chimiques. Le nombre d'électrons de valence détermine la valence d'un atome.
À mesure qu'on descend dans un groupe, le nombre d'électrons de valence ne change pas. Par conséquent, tous les éléments d'un groupe particulier ont la même valence[15],[16].
En se déplaçant de gauche à droite le long d'une période, le nombre d'électrons de valence des éléments augmente et varie entre 1 et 8 (en dehors des atomes des couches d et f). La valence augmente d'abord de 1 à 4, puis elle diminue jusqu'à zéro lorsqu'on atteint les gaz nobles.
À noter que cette tendance périodique est peu suivie pour les éléments lourds, en particulier pour le bloc f et les métaux de transition. Ces éléments présentent une valence variable car les énergies des avant-dernières et des dernières orbitales, respectivement (n-1)d et ns, sont relativement proches[17],[18].
Propriétés métalliques et non métalliques[modifier | modifier le code]
Les propriétés métalliques augmentent généralement dans le bas du tableau. Les électrons les plus externes sont plus lâchement liés car l'interaction noyau-électrons de valence diminue. Ces électrons sont davantage capables de conduire la chaleur et l'électricité.
En suivant une période de gauche à droite, l'interaction croissante entre les noyaux et les électrons les plus externes va diminuer le caractère métallique des atomes.
Suivant la tendance inverse, le caractère non métallique diminue au fil des groupes et augmente au fil des périodes[19],[20].
Références[modifier | modifier le code]
- (en) The Periodic Table I, vol. 181, coll. « Structure and Bonding », (ISBN 978-3-030-40024-8, DOI 10.1007/978-3-030-40025-5, S2CID 211038510, lire en ligne).
- (en) Gary J. Schrobilgen, « Chemistry at the Edge of the Periodic Table: The Importance of Periodic Trends on the Discovery of the Noble Gases and the Development of Noble-Gas Chemistry », dans The Periodic Table I: Historical Development and Essential Features, Springer International Publishing, (ISBN 978-3-030-40025-5, DOI 10.1007/430_2019_49), p. 157–196.
- « atomic and ionic radius », chemguide.co.uk (consulté le ).
- Maurice L. Huggins, « Atomic Radii. I », Physical Review, vol. 19, no 4, , p. 346–353 (DOI 10.1103/PhysRev.19.346, lire en ligne).
- (en) « 7.4: Ionization Energy », Chemistry LibreTexts, (consulté le ).
- (en-US) « Ionization Energy Trend », sciencetrends.com, (consulté le ).
- (en) Dariush H. Zadeh, « Atomic shells according to ionization energies », Journal of Molecular Modeling, vol. 25, no 8, , p. 251 (ISSN 0948-5023, PMID 31346734, DOI 10.1007/s00894-019-4112-6, S2CID 198913558).
- (en) « Electron affinity », dans Encyclopedic Dictionary of Polymers, Springer, (ISBN 978-0-387-30160-0, DOI 10.1007/978-0-387-30160-0_4245), p. 350–350.
- (en-US) « Electron Affinity Trend », sciencetrends.com, (consulté le ).
- (en) « electronegativity », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8).
- (en) Barry R. Bickmore et Matthew C. F. Wander, « Electronegativity », dans Encyclopedia of Geochemistry: A Comprehensive Reference Source on the Chemistry of the Earth, Springer International Publishing, (ISBN 978-3-319-39312-4, DOI 10.1007/978-3-319-39312-4_222), p. 442–444.
- (en) John Mullay, « Estimation of atomic and group electronegativities », Electronegativity, Springer, , p. 1–25 (ISBN 978-3-540-47786-0, DOI 10.1007/BFb0029834, lire en ligne, consulté le ).
- (en) « 21.1: The Elements of Group 13 », Libretexts, (consulté le ).
- (en) Daniel Franz et Shigeyoshi Inoue, « Advances in the development of complexes that contain a group 13 element chalcogen multiple bond », Dalton Transactions, vol. 45, no 23, , p. 9385–9397 (ISSN 1477-9226, PMID 27216700, DOI 10.1039/C6DT01413E, lire en ligne).
- (en) « valency », dans Dictionary of Gems and Gemology, Springer, (ISBN 978-3-540-72816-0, DOI 10.1007/978-3-540-72816-0_22746), p. 899–899.
- (en) « Valency », dans Encyclopedia of Immunotoxicology, Springer, (ISBN 978-3-642-54596-2, DOI 10.1007/978-3-642-54596-2_201542), p. 947–947.
- (en) Valency, coll. « Heidelberg Science Library », (ISBN 978-0-387-90268-5, DOI 10.1007/978-1-4612-6262-6, lire en ligne).
- (en) M. F. O’Dwyer, J. E. Kent et R. D. Brown, « Many-electron Atoms », dans Valency, Springer, (ISBN 978-1-4612-6262-6, DOI 10.1007/978-1-4612-6262-6_4), p. 59–86.
- (en) Murray S. Daw, Stephen M. Foiles et Michael I. Baskes, « The embedded-atom method: a review of theory and applications », Materials Science Reports, vol. 9, no 7, , p. 251–310 (ISSN 0920-2307, DOI 10.1016/0920-2307(93)90001-U).
- (en) « C9.1 – Periodic Trends », IGCSE AID, (consulté le ).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) Tableau périodique des éléments, IUPAC
