Protéine précurseur de l'amyloïde

La protéine précurseur de l'amyloïde (APP en anglais pour amyloid precursor protein) est une glycoprotéine transmembranaire de type I appartenant à la famille APP qui rassemble chez les mammifères, y compris l'homme, trois orthologues aux fonctions partiellement redondantes : APP, APLP 1 et 2 (Amyloid Precursor-Like Protein). Exprimée dans l'ensemble du corps humain, c'est dans le cortex cérébral que l'on retrouve la plus forte expression d'APP.
La protéine précurseur de l'amyloïde est conservée par l'évolution, on la retrouve chez la mouche[1], suggérant qu'elle possède une importante fonction physiologique[2]. L'APP serait impliquée dans de nombreuses fonctions comme le développement du système nerveux périphérique, la croissance et le transport axonal, la synaptogenèse, la survie neuronale et le comportement, notamment la mémoire[3].
Il existe deux voies majoritaires du métabolisme de l'APP, la voie amyloïde et la voie non amyloïde. La première de ces voies aboutit à la production du peptide β-amyloïde impliqué dans la maladie d'Alzheimer[4]. En effet dans cette pathologie, on retrouve des agrégats toxiques de ce peptide. C'est pour cela qu'APP est devenue le sujet de recherches scientifiques intenses.
Structure d'APP
[modifier | modifier le code]Cette protéine est composée d'un large domaine N-terminal et d'un domaine C-terminal de taille plus modeste. Elle ne possède qu'un seul passage transmembranaire capable d'interagir avec le cholestérol présent dans la membrane plasmique. Codé par 18 exons et porté par le chromosome 21 chez l'homme, le produit du gène APP subit un épissage alternatif dont la résultante est la formation de trois isoformes principales avec un nombre variable d'acides aminés : APP695, APP751 et APP770. Dans le cerveau, c'est l'isoforme APP695 qui est majoritaire.
Clivage d'APP
[modifier | modifier le code]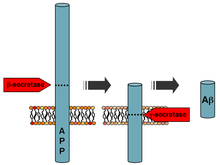
Dans le cortex des protéases, les sécrétases (α, β, γ) réalisent une séquence de clivages. Ces protéases possèdent un site de coupure spécifique ce qui permet in fine de générer en intra- ou en extracellulaire différents peptides avec des propriétés particulières.
Voie non amyloïde
[modifier | modifier le code]Cette voie, non toxique, aboutit à la production d'une région N-terminale sécrétée (sAPPα), d'une région intermédiaire (P3) et d'une région C-terminale intracellulaire (AICD, APP Intracellular Domain) par les clivages successifs de la α-sécrétase puis de la γ-sécrétase.
Voie amyloïde
[modifier | modifier le code]Cette voie, toxique, aboutit également à la production d'une région N-terminale sécrétée, mais plus courte (sAPPβ), du peptide β-amyloïde (Aβ) et du domaine intracellulaire AICD par les clivages successifs de la β-sécrétase puis de la γ-sécrétase.
Notes et références
[modifier | modifier le code]- Lien vers le gène Appl dans la base de données FlyBase
- (en) Cassar M et Kretzschmar D., « Analysis of Amyloid Precursor Protein Function in Drosophila melanogaster. », Front Mol Neurosci., vol. 9, , p. 61 (PMID 27507933, PMCID PMC4960247, DOI 10.3389/fnmol.2016.00061, lire en ligne [EPUB], consulté le )

- (en) Preat T et Goguel V., « Role of Drosophila Amyloid Precursor Protein in Memory Formation. », Front Mol Neurosci., vol. 9, , p. 142 (PMID 28008309, PMCID PMC5143682, DOI 10.3389/fnmol.2016.00142, lire en ligne [EPUB], consulté le )

- (en) Selkoe DJ et Hardy J., « The amyloid hypothesis of Alzheimer's disease at 25 years. », EMBO Mol Med., vol. 8, no 6, , p. 595-608 (PMID 27025652, PMCID PMC4888851, DOI 10.15252/emmm.201606210, lire en ligne [PDF], consulté le )

Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Agnès Hémar et Christophe Mulle, « Maladie d’Alzheimer, peptide β-amyloïde et synapses », Med Sci (Paris), vol. 27, nos 8-9, , p. 733-736 (PMID 21880261, DOI 10.1051/medsci/2011278015, lire en ligne, consulté le ).
