Oxalate
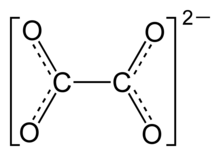
L'ion oxalate, aussi appelé éthanedioate C2O42-, est la dibase conjuguée d'un diacide, l'acide oxalique (ou acide éthanedioïque) C2O4H2. Les couples acide/base concernés sont :
- l'acide oxalique et sa base conjuguée l'ion hydrogénoxalate C2O4H2 / HC2O4-
- l'ion hydrogénoxalate et sa base conjuguée l'ion oxalate HC2O4- / C2O42-
Demi-équations acide-base
- C2O4H2 HC2O4- + H+
- HC2O4- C2O42- + H+
Oxalates et santé

Les oxalates cristallisés sont dans certaines conditions toxiques.
De l'oxalate en poudre est utilisé comme pesticide dans les élevages apicoles pour combattre les acariens qui parasitent les abeilles.
Dans le corps humain, l'acide oxalique se combine avec des cations métalliques divalents comme le calcium (Ca 2 + ) et/ou le fer (II) (Fe 2 + ) pour former les cristaux d'oxalates correspondants, qui sont ensuite excrétés dans urine sous forme de petits cristaux.
Parfois ces oxalates forment des concrétions plus importantes (calcul rénal pouvant douloureusement obstruer les tubules rénaux. Environ 80 % des calculs rénaux seraient formés à partir d'oxalate de calcium[1].
Les patients concernés par certains troubles rénaux, la goutte, la polyarthrite rhumatoïde, ou certaines formes de douleur vulvaire chronique (vulvodynie) devraient éviter les aliments riches en acide oxalique [réf. nécessaire]. Diverses études portent sur des moyens de limiter les risques liés à l'ingestion d'aliments contenant beaucoup d'acide oxalique (rhubarbe, épinards par exemple)[2].
L'oxalate de magnésium (Mg 2 + ) est de 567 fois plus soluble que l'oxalate de calcium [réf. nécessaire]. Ce dernier est donc plus susceptible de précipiter. L'oxalate de magnésium est un million de fois plus soluble que l'oxalate de mercure. Parmi les oxalates de métaux, la solubilité du cristal diminue selon l'ordre suivant Mg > Ca > Cd > Zn > {Mn, Ni, Fe, Cu} > {As, Sb, Pb} > Hg [réf. nécessaire]
L'oxalate de fer(II) est très insoluble. Il semble jouer un rôle majeur dans la goutte, dans la nucléation et la croissance du très soluble acide urique (urate de sodium), ce qui explique que la goutte apparaisse après 40 ans, quand le taux sanguin de ferritine dépasse 1 ug/L. La bière est riche en oxalate et en fer, et l'éthanol augmente l'absorption du fer ainsi que l'élimination de magnésium, ce pourquoi la consommation de bière augmente considérablement le risque d'une crise de goutte.
Le cadmium catalyse la transformation de vitamine C en acide oxalique, ce qui est une source de risque pour les personnes dont l'organisme est contaminé par le cadmium via leur alimentation, eau de boisson, le lieu de travail, ou via le tabagisme.
Une étude basée sur le modèle animal (rat de laboratoire) a conclu qu'une supplémentation en calcium associée à des aliments riches en acide oxalique peut faire précipiter l'oxalate de calcium dans l'intestin et fortement réduire le niveau d'oxalate absorbé par le corps (de 97 % dans certains cas) [3],[4]
Une réaction métabolique impliquant l'éthylène glycol ("antigel"), l'acide glyoxylique, ou l'acide ascorbique (vitamine C) peut aussi produire de l'acide oxalique[5].
Quelques champignons (du genre Aspergillus ) produisent de l'acide oxalique [6].
Des données préliminaires semblent montrer que l'administration de probiotiques peut significativement diminuer les taux d'excrétion d'acide oxalique [7]
Notes et références
- (en) Coe, Evan et Worcester, « Kidney stone disease », The Journal of Clinical Investigation, vol. 115, no 10, , p. 2598–608 (PMID 16200192, PMCID 1236703, DOI 10.1172/JCI26662)
- (en) T. Betsche et B. Fretzdorff, « Biodegradation of oxalic acid from spinach using cereal radicles », Journal of Agricultural and Food Chemistry, vol. 53, no 25, , p. 9751–8 (PMID 16332126, DOI 10.1021/jf051091s)
- (en) Makoto Morozumi, Rayhan Zubair Hossain, Ken'ichi Yamakawa, Sanehiro Hokama, Saori Nishijima, Yoshinori Oshiro, Atsushi Uchida, Kimio Sugaya et Yoshihide Ogawa, « Gastrointestinal oxalic acid absorption in calcium-treated rats », Urological research, vol. 34, no 3, , p. 168–72 (PMID 16705467, DOI 10.1007/s00240-006-0035-7)
- (en) R. Z. Hossain, Y. Ogawa, M. Morozumi, S. Hokama et K. Sugaya, « Milk and calcium prevent gastrointestinal absorption and urinary excretion of oxalate in rats », Frontiers in Bioscience, vol. 8, nos 1–3, , a117–25 (PMID 12700095, DOI 10.2741/1083)
- (en) Mandl, Szarka et Bánhegyi, « Vitamin C: update on physiology and pharmacology », British Journal of Pharmacology, vol. 157, no 7, , p. 1097–1110 (PMID 19508394, PMCID 2743829, DOI 10.1111/j.1476-5381.2009.00282.x)
- (en) Uğur Pabuççuoğlu, « Aspects of oxalosis associated with aspergillosis in pathology specimens », Pathology – Research and Practice, vol. 201, no 5, , p. 363–8 (PMID 16047945, DOI 10.1016/j.prp.2005.03.005)
- (en) J. C. Lieske, D. S. Goldfarb, C. De Simone et C. Regnier, « Use of a probiotic to decrease enteric hyperoxaluria », Kidney international, vol. 68, no 3, , p. 1244–9 (PMID 16105057, DOI 10.1111/j.1523-1755.2005.00520.x)

