Dicoumarol
| Dicoumarol | |
| |
| Identification | |
|---|---|
| Nom UICPA | 3,3'-méthanediylbis(4-hydroxy-2H-chromén-2-one) |
| No CAS | |
| No ECHA | 100.000.575 |
| Code ATC | B01 |
| SMILES | |
| InChI | |
| Apparence | cristaux à odeur agréable, goût légèrement amer |
| Propriétés chimiques | |
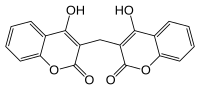
| Formule | C19H12O6 [Isomères] |
| Masse molaire[1] | 336,295 ± 0,017 8 g/mol C 67,86 %, H 3,6 %, O 28,55 %, |
| Propriétés physiques | |
| T° fusion | 287 à 293 °C |
| Solubilité | Presque insol dans l'eau, l'alcool, l'éther. Peu sol dans le benzène et le chloroforme. Sol dans la pyridine, les solutions aqueuses alcalines |
| Précautions | |
| SGH[2] | |
| H302, H372 et H411 |
|
| Écotoxicologie | |
| DL50 | rats 541,6 mg·kg-1 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dicoumarol ou hydroxycoumarine est un dérivé de la coumarine.
Initialement utilisé à forte dose comme raticide (antivitamine K qui cause de graves hémorragies internes, employé dans l'appât rodenticide de type mort aux rats), il a été utilisé à faible dose en clinique comme anticoagulant avant d'être supplanté par un de ses dérivés : la warfarine (Coumadine®)[3].
Au même titre que l'héparine (F. C. Mac Lean, 1917), le dicoumarol (K. Link, 1941) fait partie des chefs de file des anticoagulants.

.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- François Couplan, Eva Styner, Guide des plantes sauvages comestibles et toxiques, Delachaux et Niestlé, , p. 106



