Acide iminodiacétique
| Acide iminodiacétique | |
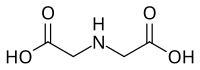
| |
| Structure de l'acide iminodiacétique | |
| Identification | |
|---|---|
| Nom UICPA | acide 2-(carboxyméthylamino)acétique |
| Synonymes |
diglycine |
| No CAS | |
| No ECHA | 100.005.051 |
| No CE | 205-555-4 |
| No RTECS | AI2975000 |
| ChEBI | 24786 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C4H7NO4 [Isomères] |
| Masse molaire[1] | 133,102 7 ± 0,005 1 g/mol C 36,09 %, H 5,3 %, N 10,52 %, O 48,08 %, |
| Propriétés physiques | |
| T° fusion | 243 °C[2] (décomposition) |
| Précautions | |
| SGH[2] | |
| H315, H319, H335, P261 et P305+P351+P338 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide iminodiacétique (IDA) est un acide dicarboxylique aminé dont l'atome d'azote forme une amine secondaire et non une fonction imine, contrairement à ce que son nom indique. L'anion iminodiacétate forme un ligand tridenté formant avec les cations de métaux de transition tels que Cu2+, Co2+, Ni2+ et Zn2+ des complexes métalliques stables à deux chélates cycliques fusionnés. Le complexe métallique formé est plus stable que celui formé avec un ligand bidenté comme la glycine mais moins stable que celui formé avec un ligand tétradenté comme l'acide nitrilotriacétique (NTA).

On l'obtient au cours de la déshydrogénation catalytique de la diéthanolamine HN(CH2CH2OH)2 avec un rendement voisin de 95 %. Il peut également être produit à partir d'iminodiacétonitrile N≡C–CH2–NH–CH2–C≡N avec un rendement supérieur à 80 %. C'est un précurseur de la synthèse industrielle de l'acide N-(phosphonométhyl)iminodiacétique (PMIDA) et du glyphosate, principe actif du désherbant total Roundup de Monsanto, entré dans le domaine public à la fin du siècle dernier (2000).
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Iminodiacetic acid 98%, consultée le 6 octobre 2013.

