Électrofilage


L'électrofilage, electrospinning ou filature par voie électrostatique est une méthode de production de fibres qui utilise une force électrique pour tirer des fils de polymères chargés en solution ou fondus jusqu'à des diamètres de l'ordre de centaines de nanomètres. L'électrofilage partage des caractéristiques de l'électronébulisation et du filage sec traditionnel des fibres[1]. Le processus ne nécessite pas l'utilisation de coagulation chimique ou de hautes températures pour produire des fibres solides à partir d'une solution. Cela rend le processus particulièrement adapté à la production de fibres utilisant des molécules larges ou complexes. L'électrofilage peut également être effectué à partir de précurseurs fondus ; cette méthode permettant de garantir qu'aucun solvant ne sera transferré au produit final.
Processus
Lorsqu'une tension électrique suffisamment haute est appliquée à une gouttelette de liquide, le corps du liquide se charge, et la force de répulsion électrostatique s'oppose alors à la tension de surface forçant la gouttelette à s'étirer ; à un point critique, un flux de liquide jaillit de la surface. Ce point de l'éruption est appelé « cône de Taylor ». Si la cohésion moléculaire du liquide est suffisamment élevée, il n'y a pas de rupture du flux et un jet chargé de liquide est formé (si une rupture a lieu, des gouttelettes sont électropulvérisée)[2],[3].
Comme le jet sèche en vol, le mode de circulation du courant change de ohmique à convectif tandis que les charges migrent à la surface de la fibre. Le jet est alors allongé par un processus causé par la répulsion électrostatique initiée au niveau de petits plis sur la fibre, jusqu'à ce qu'elle soit finalement déposée sur la mise à la terre du collecteur[4]. L'allongement et l'amincissement de la fibre résultant de cette instabilité de flexion conduit à la formation de fibres uniformes de diamètres de l'ordre du nanomètre[5].
Paramètres
- Poids moléculaire, distribution du poids moléculaire et architecture du polymère
- Propriétés en solution (viscosité, conductivité et tension de surface)
- Potentiel électrique, débit et concentration
- Distance entre les capillaires sur la surface du collecteur
- Paramètre ambiants (température, humidité et vitesse du flux d'air dans la chambre
- Comportement et taille de l'écran du collecteur
- Jauge aiguille
Appareillage
L'installation de laboratoire pour électrofilage standard se compose d'une filière (généralement une aiguille de seringue hypodermique) alimentées en courant continu à haute tension (de 5 à 50 kV), une pompe à seringue, et un collecteur mis à la terre. Une solution de polymère, sol-gel, une suspension de particules ou un polymère fondu est chargé dans la seringue et le liquide est évacué à la pointe de la seringue à un taux constant par la pompe à seringue[6]. Une autre possibilité est d'alimenter la goutte à l'extrémité de la filière à partir d'un réservoir à pression constante. Cette seconde solution est recommandée pour les polymères à basses viscosités.
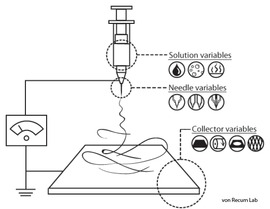 |
 |
Augmentation des capacités de production
- Multiplication du nombre d'aiguilles[7]
- Roller electrospinning
- Électrofilage par câble (wire electrospinning)
- Électrofilage par bulle (bubble electrospinning)[8]
- Électrofilage par boule (ball electrospinning)
- Électrofilage haute-vitesse[9]
- Électrofilage sur arrête (plate edge electrospinning)[10]
- Électrofilage par bol (bowl electrospinninge)[11]
- Électrofilage par tube creux (hollow tube electrospinning)[12]
- Électrofilage par cône rotatif (rotary cone electrospinning)[13]
- Électrofilage par bobine (spiral coil electrospinning)[14]
- Électrosoufflage (electroblowing)[15]
- Électrofilage sans aiguille (needleless electrospinning)[16]
- Électrofilage à courant alternatif (alternating current electrospinning)[17]
Autres techniques
Des modificationss de la filière et/ou du type de solution peuvent permettre la création de fibres aux structures et propriétés uniques. Les fibres électrofilées peuvent adopter une morphologie poreuse ou en core–shell (noyau-gaine) en fonction du type de matériaux utilisés ainsi que du taux d'évaporation et de miscibilité des solvants impliqués. Pour les techniques impliquant plusieurs fluides pendant la filation, les critères généraux des fibres créées dépendent de la fiabilité de la solution extérieure[18]. Cela ouvre la possibilité de création de fibres composites pouvant servir à la délivrance de médicaments ou possédant la capacité d'auto-réparation en cas de rupture[19],[20].
Électrofilage coaxial

Un dispositif coaxial utilise un système d'alimentation à double-injection qui permet l'injection d'une solution dans une autre à l'aide d'une filière. La gaine liquide est censé agir comme un transporteur qui tire le fluide intérieur à l'extrémité du Cône de Taylor[18]. Si les solutions sont non miscibles on observe la formation d'une structure en core-shell (noyau-gaine). Les solutions miscibles peuvent toutefois entraîner la formation de porosité ou de fibres faites de phases distinctes en raison de la séparation de phase lors de la solidification de la fibre. Pour les installations les plus avancées, des filières tri-axiales voir quadri-axiale peuvent être utilisées.
Électrofilage émulsif
Des émulsions peuvent être utilisés pour créer une structure core-shell (noyau-gaine) sans modification de la filière. Cependant, ces fibres sont généralement plus difficiles à produire que par électrofilage coaxial en raison du grand nombre de variables qui doivent être prises en compte dans la création de l'émulsion. Une phase aqueuse et une phase d'un solvant non miscible sont mélangées en présence d'un agent réactif pour former l'émulsion. N'importe quel agent capable de stabiliser l'interface entre les phases non miscibles peut être utilisé. Les agents tensioactifs tels que le Laurylsulfate de sodium, Triton ainsi que des nanoparticules ont été utilisés avec succès. Pendant le processus d'électrofilage les gouttelettes issues de l'émulsion sont étirés dans le liquide et progressivement confiné jusqu'à leur coalescence. Si la fraction volumique interne du fluide est suffisamment élevé, un noyau interne continu peut être formé[21].
L'électrofilage de mélanges est une variante de cette technique qui utilise le fait que les polymères sont généralement non miscibles entre eux et peuvent se séparer sans avoir recours à des surfactants. Cette méthode peut encore être simplifiée si un solvant capable de dissoudre les deux polymères est utilisé[22].
Électrofilage à polymère fondu
L'électrofilage à polymères fondus élimine le besoin de solvants volatils dans la solution utilisée[23]. Les fibres polymères semi-cristallines tels que le PE, PET et PP, qui autrement seraient impossible ou très difficile à filer avec l'électrofilage de solutions, peuvent ainsi être créés. Le matériel utilisé est très similaire à celui employé dans les autres configurations et comprend l'utilisation d'une seringue ou d'une filière, une haute tension d'alimentation et un collecteur. Le polymère fondu est généralement produit par le chauffage par résistance, circulation de fluides, d'air ou par lasers[24].
En raison de la forte viscosité des polymères fondus, le diamètre des fibres est généralement légèrement plus grand que ceux obtenus à partir d'une solution d'électrofilage. L'homogénéité de la fibre à assurer la stabilité du taux d'écoulement et l'équilibre thermique, a tendance à être très bon. L'instabilité de « fouettage » (Whipping), étape principale durant laquelle la fibre est étirée pour la filature à partir de solutions, peut être absente du processus en raison de la basse température de la conductivité et de la viscosité élevée de la fonte. Les facteurs les plus importants qui affectent la taille des fibres sont en général le débit d'alimentation, le poids moléculaire du polymère et le diamètre de la filière. Les fibres de tailles allant d'environ 250 nm à plusieurs centaines de micromètres ont été créés jusqu'à maintenant avec, pour les tailles les plus petites, des polymères à poids moléculaire faible[25].
Utilisation
La taille de fibres électrofilées peut être nanométrique et les fibres peuvent posséder des textures de surface d'échelle également nanométrique, induisant un comportement différent des « macro-matériaux » lors d'interaction avec d'autres composés.[26] En plus de cela, les fibres produites par électrofilage sont censées avoir deux propriétés principales, un rapport surface/volume très élevé, et une structure moléculaire relativement exempte de défauts. Cette première propriété rend les matériaux électrofilées particulièrement adaptés pour les activités nécessitant un haut degré de contact physique (comme pour héberger des réactions chimiques ou capturer des particules de petite taille lors d'une filtration par enchevêtrement physique par exemple). La deuxième propriété permet aux fibres électrofilées d'avoir une résistance théorique proche de la résistance maximale d'un matériel ouvrant la possibilité de matériaux composites de haute performance.
Filtration
L'utilisation de nanofibres toiles comme moyen de filtration est assez courante. En raison de leur petite taille, les fibres de London-van der Waals sont une méthode de filtration utiles en raison de l'adhérence entre les fibres et les matériels capturés. Les nanofibres polymères ont été utilisées dans des applications de filtration d'air pendant plus de 70 ans[27],[28]. En raison des mauvaise propriétés mécaniques des couches minces des nanowebs (nano-tissages), elles sont généralement posées sur un moyen de filtration du substrat. Le petit diamètre des fibres provoque le glissement des flux à la surface des fibres, ce qui engendre une augmentation de l'interception et de l'impaction inertielle de l'efficacité de ces composites. Le renforcement de l'efficacité de la filtration à la même chute de pression est possible avec des fibres ayant un diamètre inférieur à 0.5 micromètre. Les membranes en nanofibres électrofilées sont de bons candidats pour ces applications.[29]
Utilisations textiles
La majorité des premiers brevets d'électrofilage ont été pour des applications textiles, cependant peu de tissu ont été effectivement produits, peut-être en raison de difficultés de maniement de ces fibres à peine visibles. Cependant, l'électrofilage a le potentiel de produire un fluide non-tissé de vêtements par l'intégration de la fabrication de pointe avec de la fibre de électrofilage. Cela introduit une multi-fonctionnalité en mélangeant des fibres electrospinlaced (électro-entrelacées) (électrofilage de différents types de fibres et de revêtements pour former des formes en trois dimensions, tels que les vêtements)[30],[31].
Utilisations médicales
L'électrofilage peut également être utilisé à des fins médicales[32]. Les produits électrofilées faits pour l'ingénierie tissulaire peuvent être utilisées pour pénétrer des cellules à traiter ou remplacer des cibles biologiques[33]. Les pansements en nanofibres ont une excellente capacité à isoler la plaie contre les infections microbiennes[34]. D'autres matières textiles médicales, telles que les sutures, sont également réalisables par électrofilage[35]. L'ajout d'une substance médicamenteuse est possible dans la solution électrofilée ou lors de la fonte de divers systèmes fibreux de délivrance de médicaments[36] (par exemple les implants[37], les patchs transdermiques[38], les formes orales[39]).
Utilisations pharmaceutiques
Le continu et l'efficacité de séchage à l'effet de permettre l'intégration de l'électrofilage en continu de la fabrication de produits pharmaceutiques de systèmes[40]. Le synthétisait le médicament liquide peut être rapidement transformé en un électrofilées produit solide qui permet de les traiter pour les installations de production de comprimés et d'autres formes de dosage.
Composites

L'électrofilage de fibres dites "ultra-fines" montre un important potentiel dans la fabrication de matériaux composites à fibres longues[41].
L'application demeure limitée par des difficultés dans la prise de quantités suffisantes de fibres et la transposition des techniques à grande échelle et dans des délais économiquement viables. Pour ces raisons, les applications médicales (nécessitant des quantités relativement petites de fibres) constitue le cœur de marché des matériaux renforcés de fibres électrofilées.
Catalyseurs
Les fibres électrofilées peuvent servir de sufaces pour l'immobilisation d'enzymes. Ces derniers pourraient par la suite être utilisés pour briser (et éliminer) des produits chimiques toxiques dans l'environnement[5].
Production à grande échelle
Au moins sept pays dans le monde ont aujourd'hui des entreprises avec des capacités industrielles d'électrofilage: la République Tchèque en possède trois, l'Iran, le Japon, et l'Espagne deux chacun, et les Pays-Bas, l'Italie et la Turquie une chacun.
Références
- Ziabicki, A. (1976), Fundamentals of fiber formation, John Wiley & Sons, Londres (ISBN 0-471-98220-2).
- High speed video of the taylor cone formation and electrospinning, YouTube
- Single nozzle electrospinning process nanofiber formation video, YouTube
- High speed video of the whipping instability, YouTube
- D. Li et Y. Xia, « Electrospinning of Nanofibers: Reinventing the Wheel? », Advanced Materials, vol. 16, no 14, , p. 1151–1170 (DOI 10.1002/adma.200400719)
- Sonia R. Merritt, Agata A. Exner, Zhenghong Lee et Horst A. von Recum, « Electrospinning and Imaging », Advanced Engineering Materials, vol. 14, no 5, , B266–B278 (DOI 10.1002/adem.201180010)
- Varesano, A., Carletto, R.A. et Mazzuchetti, G., « Experimental investigations on the multi-jet electrospinning process », Journal of Materials Processing Technology, vol. 209, no 11, , p. 5178–5185 (DOI 10.1016/j.jmatprotec.2009.03.003, lire en ligne)
- Liu, Y., He, J.-H. et Yu, J.-Y., « Bubble-electrospinning: a novel method for making nanofibers », Journal of Physics: Conference Series, vol. 96, , p. 012001 (DOI 10.1088/1742-6596/96/1/012001)
- Nagy, Z.K., Balogh, A., Démuth, B., Pataki, H., Vigh, T., Szabó, B., Molnár, K., Schmidt, B.T., Horák, P. et Marosi, G., « High speed electrospinning for scaled-up production of amorphous solid dispersion of itraconazole », International Journal of Pharmaceutics, vol. 480, nos 1–2, , p. 137–142 (PMID 25596415, DOI 10.1016/j.ijpharm.2015.01.025, lire en ligne)
- Thoppey, N.M., Bochinski, J.R., Clarke, L.I. et Gorga, R.E., « Unconfined fluid electrospun into high quality nanofibers from a plate edge », Polymer, vol. 51, no 21, , p. 4928–4936 (DOI 10.1016/j.polymer.2010.07.046, lire en ligne)
- Thoppey, N., Bochinski, J., Clarke, L. et Gorga, R., « Edge electrospinning for high throughput production of quality nanofibers », Nanotechnology, vol. 22, no 34, , p. 345301 (PMID 21799242, DOI 10.1088/0957-4484/22/34/345301, lire en ligne)
- Varabhas, J., Chase, G. et Reneker, D., « Electrospun nanofibers from a porous hollow tube », Polymer, vol. 49, no 19, , p. 4226–4229 (DOI 10.1016/j.polymer.2008.07.043, lire en ligne)
- Lu, B., Wang, Y., Liu, Y., Duan, H., Zhou, J., Zhang, Z., Wang, Y., Li, X., Wang, W. et Lan, W., « Superhigh‐Throughput Needleless Electrospinning Using a Rotary Cone as Spinneret », Small, vol. 6, no 15, , p. 1612–1616 (PMID 20602427, DOI 10.1002/smll.201000454)
- Lee JH, Shin DW, Nam KB, Gim YH, Ko HS, Seo DK, Lee GH, Kim YH, Kim SW, Oh TS, Yoo JB, « Continuous bundles of aligned electrospun PAN nano-fiber using electrostatic spiral collector and converging coil », Polymer, vol. 84, no 10, , p. 52–58 (DOI 10.1016/j.polymer.2015.11.046, lire en ligne)
- Attila Balogh, Tímea Horváthová, Zoltán Fülöp, Thorsteinn Loftsson, Anna Helga Harasztos, György Marosi et Zsombor K. Nagy, « Electroblowing and electrospinning of fibrous diclofenac sodium-cyclodextrin complex-based reconstitution injection », Journal of Drug Delivery Science and Technology, vol. 26, , p. 28–34 (DOI 10.1016/j.jddst.2015.02.003)
- Niu, Haitao et Lin, Tong, « Fiber generators in needleless electrospinning », Journal of Nanomaterials, vol. 12, (lire en ligne)
- Attila Balogh, Richárd Cselkó, Balázs Démuth, Geert Verreck, Jürgen Mensch, György Marosi et Zsombor Kristóf Nagy, « Alternating current electrospinning for preparation of fibrous drug delivery systems », International Journal of Pharmaceutics, vol. 495, no 1, , p. 75–80 (PMID 26320549, DOI 10.1016/j.ijpharm.2015.08.069)
- Alexander V. Bazilevsky, Alexander L. Yarin et Constantine M. Megaridis, « Co-electrospinning of Core−Shell Fibers Using a Single-Nozzle Technique », Langmuir, vol. 23, no 5, , p. 2311–4 (PMID 17266345, DOI 10.1021/la063194q)
- J Zeng, X Xu, X Chen, Q Liang, X Bian, L Yang et X Jing, « Biodegradable electrospun fibers for drug delivery », Journal of Controlled Release, vol. 92, no 3, , p. 227–31 (PMID 14568403, DOI 10.1016/S0168-3659(03)00372-9)
- S. Sinha-Ray, D. D. Pelot, Z. P. Zhou, A. Rahman, X.-F. Wu et A. L. Yarin, « Encapsulation of self-healing materials by coelectrospinning, emulsion electrospinning, solution blowing and intercalation », Journal of Materials Chemistry, vol. 22, no 18, , p. 9138 (DOI 10.1039/C2JM15696B)
- Xiuling Xu, Xiuli Zhuang, Xuesi Chen, Xinri Wang, Lixin Yang et Xiabin Jing, « Preparation of Core-Sheath Composite Nanofibers by Emulsion Electrospinning », Macromolecular Rapid Communications, vol. 27, no 19, , p. 1637–1642 (DOI 10.1002/marc.200600384)
- Song Lin, Qing Cai, Jianying Ji, Gang Sui, Yunhua Yu, Xiaoping Yang, Qi. Ma, Yan Wei et Xuliang Deng, « Electrospun nanofiber reinforced and toughened composites through in situ nano-interface formation », Composites Science and Technology, vol. 68, nos 15–16, , p. 3322–3329 (DOI 10.1016/j.compscitech.2008.08.033, lire en ligne)
- Nagy, Z.K., Balogh, A., Drávavölgyi, G., Ferguson, J., Pataki, H., Vajna, B. et Marosi, G., « Solvent-free melt electrospinning for preparation of fast dissolving drug delivery system and comparison with solvent-based electrospun and melt extruded systems », Journal of Pharmaceutical Sciences, vol. 102, no 2, , p. 508–17 (PMID 23161110, DOI 10.1002/jps.23374)
- Dietmar W. Hutmacher et Paul D. Dalton, « Melt Electrospinning », Chemistry: An Asian Journal, vol. 6, no 1, , p. 44–56 (PMID 21080400, DOI 10.1002/asia.201000436)
- Paul D. Dalton, Dirk Grafahrend, Kristina Klinkhammer, Doris Klee et Martin Möller, « Electrospinning of polymer melts: Phenomenological observations », Polymer, vol. 48, no 23, , p. 6823–6833 (DOI 10.1016/j.polymer.2007.09.037, lire en ligne [archive du ])
- Ajayan P. M., Schadler, L. S. et Braun, P. V. (2003), Nanocomposite Science and Technology, Weinheim, Wiley-VCH (ISBN 9783527602124), DOI 10.1002/3527602127.
- Filatov, Y. Budyka, A. Kirichenko, V. (Trans. D. Letterman) (2007) Electrospinning of micro- and nanofibers: fundamentals and applications in separation and filtration processes, Begell House Inc., New York (ISBN 978-1-56700-241-6).
- Donaldson Nanofiber Products « https://web.archive.org/web/20110710143633/http://www.donaldson.com/en/filtermedia/nanofibers/ »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?),
- Thandavamoorthy Subbiah, G. S. Bhat, R. W. Tock, S. Parameswaran et S. S. Ramkumar, « Electrospinning of nanofibers », Journal of Applied Polymer Science, vol. 96, no 2, , p. 557–569 (DOI 10.1002/app.21481)
- S. Lee et S. K. Obendorf, « Use of Electrospun Nanofiber Web for Protective Textile Materials as Barriers to Liquid Penetration », Textile Research Journal, vol. 77, no 9, , p. 696–702 (DOI 10.1177/0040517507080284)
- Yu-Jun Zhang et Yu-Dong Huang « Electrospun non-woven mats of EVOH » () (DOI 10.1109/DEIV.2004.1418615)
— « (ibid.) », dans XXIst International Symposium on Discharges and Electrical Insulation in Vacuum, 2004. Proceedings. ISDEIV, vol. 1 (ISBN 0-7803-8461-X), p. 106 - Travis J. Sill et Horst A. von Recum, « Electrospinning: Applications in drug delivery and tissue engineering », Biomaterials, vol. 29, no 13, , p. 1989–2006 (PMID 18281090, DOI 10.1016/j.biomaterials.2008.01.011)
- Wan-Ju Li, Cato T. Laurencin, Edward J. Caterson, Rocky S. Tuan et Frank K. Ko, « Electrospun nanofibrous structure: A novel scaffold for tissue engineering », Journal of Biomedical Materials Research, vol. 60, no 4, , p. 613–621 (PMID 11948520, DOI 10.1002/jbm.10167)
- Myung-Seob Khil, Dong-Il Cha, Hak-Yong Kim, In-Shik Kim et Narayan Bhattarai, « Electrospun nanofibrous polyurethane membrane as wound dressing », Journal of Biomedical Materials Research, vol. 67B, no 2, , p. 675–679 (PMID 14598393, DOI 10.1002/jbm.b.10058)
- Christopher B. Weldon, Jonathan H. Tsui, Sahadev A. Shankarappa, Vy T. Nguyen, Minglin Ma, Daniel G. Anderson et Daniel S. Kohane, « Electrospun drug-eluting sutures for local anesthesia », Journal of Controlled Release, vol. 161, no 3, , p. 903–909 (PMID 22609349, PMCID 3412890, DOI 10.1016/j.jconrel.2012.05.021, hdl 1721.1/101125, lire en ligne)
- Zsombor Kristóf Nagy, Attlia Balogh, Gábor Drávavölgyi, James Ferguson, Hajnalka Pataki, Balázs Vajna et György Marosi, « Solvent-Free Melt Electrospinning for Preparation of Fast Dissolving Drug Delivery System and Comparison with Solvent-Based Electrospun and Melt Extruded Systems », Journal of Pharmaceutical Sciences, vol. 102, no 2, , p. 508–517 (PMID 23161110, DOI 10.1002/jps.23374)
- Adinarayana Andukuri, Meenakshi Kushwaha, Ajay Tambralli, Joel M. Anderson, Derrick R. Dean, Joel L. Berry, Young Doug Sohn, Young-Sup Yoon, Brigitta C. Brott et Ho-Wook Jun, « A hybrid biomimetic nanomatrix composed of electrospun polycaprolactone and bioactive peptide amphiphiles for cardiovascular implants », Acta Biomaterialia, vol. 7, no 1, , p. 225–233 (PMID 20728588, PMCID 2967669, DOI 10.1016/j.actbio.2010.08.013)
- Pattama Taepaiboon, Uracha Rungsardthong et Pitt Supaphol, « Vitamin-loaded electrospun cellulose acetate nanofiber mats as transdermal and dermal therapeutic agents of vitamin A acid and vitamin E », European Journal of Pharmaceutics and Biopharmaceutics, vol. 67, no 2, , p. 387–397 (PMID 17498935, DOI 10.1016/j.ejpb.2007.03.018)
- Zs. K. Nagy, K. Nyul, I. Wagner, K. Molnar et Gy. Marosi, « Electrospun water soluble polymer mat for ultrafast release of Donepezil HCl », Express Polymer Letters, vol. 4, no 12, , p. 763–772 (DOI 10.3144/expresspolymlett.2010.92, lire en ligne)
- Attila Balogh, András Domokos, Balázs Farkas, Attila Farkas, Zsolt Rapi, Domokos Kiss, Zoltán Nyiri, Zsuzsanna Eke, Györgyi Szarka, Róbert Örkényi, Béla Mátravölgyi, Ferenc Faigl, György Marosi et Zsombor Kristóf Nagy, « Continuous end-to-end production of solid drug dosage forms: Coupling flow synthesis and formulation by electrospinning », Chemical Engineering Journal, vol. 350, , p. 290–299 (DOI 10.1016/j.cej.2018.05.188, lire en ligne)
- K. Molnar, Vas, L.M. et Czigany, T., « Determination of tensile strength of electrospun single nanofibers through modeling tensile behavior of the nanofibrous mat », Composites Part B: Engineering, vol. 43, , p. 15–21 (DOI 10.1016/j.compositesb.2011.04.024, lire en ligne, consulté le )

