Acide chlorobenzoïque
L'acide chlorobenzoïque est un composé aromatique de formule brute C7H5ClO2. Il constitué d'un cycle benzénique substitué par un groupe carboxyle et un atome de chlore. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères, les composés ortho, méta et para, en fonction de la position relative de ces deux groupes sur le cycle.
Propriétés
[modifier | modifier le code]| Acide chlorobenzoïque | |||
| Nom | Acide 2-chlorobenzoïque | Acide 3-chlorobenzoïque | Acide 4-chlorobenzoïque |
| Autre nom | acide orthochlorobenzoïque | acide métachlorobenzoïque | acide parachlorobenzoïque |
| Représentation | 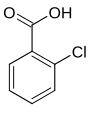
|

|
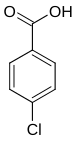
|
| Numéro CAS | |||
| PubChem | 8374 | 447 | 6318 |
| Formule brute | C7H5ClO2 | ||
| Masse molaire | 156,57 g·mol−1 | ||
| État (CNTP) | solide | ||
| Apparence | poudre blanche[1] | poudre cristalline beige[2] | poudre cristalline blanche[3] |
| Point de fusion | 139 à 142 °C[1] | 153 à 156 °C[2] | 237 à 240 °C[3] |
| Point d'ébullition | 285 °C[1] | 274 à 276 °C[2] | 274 à 276 °C[3] |
| Masse volumique | 1,544 g·cm-3 (20 °C)[1] | 1,496 g·cm-3 (25 °C)[2] | 1,54 g·cm-3 (24 °C)[3] |
| Point d'éclair | 173 °C[1] | 150 °C[2] | 238 °C[3] |
| Point d'auto-inflammation | 530 °C[1] | > 500 °C[2] | 545 °C[3] |
| Solubilité (eau) | 2,1 g·l-1 (25 °C)[1] | 0,45 g·l-1 (20 °C)[2] | 0,08 g·l-1 (20 °C)[3] |
| LogP | 1,99[1] | 2,6[2] | 2,65[3] |
| pKa[4] | 2,92 | 3,82 | 3,98 |
| SGH[1],[2],[3] | Attention | ||
| Phrase H et P[1],[2],[3] | H319 |
H315 et H319 |
H302, H315, H319 et H335 |
| P305+P351+P338 |
P305+P351+P338 |
P261 | |
Les acides chlorobenzoïques sont des solides cristallins blancs à beige. Leurs points de fusion sont très différents, l'acide 4-chlorobenzoïque qui présente la plus grande symétrie ayant le plus élevé ; leurs points d'ébullition sont en revanche très proches. Les acides chlorobenzoïques présentent une acidité plus élevée que l'acide benzoïque (pKA=4,20) en raison de l'effet -I du chlore qui stabilise l'anion benzoate.
Synthèse
[modifier | modifier le code]L'acide 4-chlorobenzoïque peut être préparé à partir du 4-chlorotoluène, par oxydation du groupe méthyle avec du permanganate de potassium en solution alcaline (en présence d'un catalyseur de transfert de phase)[5]. La préparation de l'acide 2-chlorobenzoïque est elle possible par la réaction de Sandmeyer, à partir de l'acide 2-aminobenzoïque, transformé en sel de diazonium par une réaction à température inférieure à 5 °C avec l'acide nitreux (lui-même préparé in situ à partir de nitrite de sodium et d'un acide fort, par exemple l'acide chlorhydrique). Ce sel est ensuite traité par l'acide chlorhydrique et du chlorure de cuivre(I) comme catalyseur.
Notes et références
[modifier | modifier le code]- Entrée « 2-Chlorobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire).
- Entrée « 3-Chlorobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire).
- Entrée « 4-Chlorobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 décembre 2020 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- (de) Communauté d'auteurs, Organikum, Leipzig · Berlin · Heidelberg, Johann Ambrosius Barth, , 19e éd. (ISBN 3-335-00343-8), p. 367–368

