Réaction d'Asinger
La réaction d'Asinger ou synthèse de thiazoline d'Asinger est une réaction de chimie organique. Elle a été découverte par Friedrich Asinger (en) lors de son séjour forcé en Union soviétique (Action Ossoawiachim : déportation des scientifiques allemands en URSS)[1].
La réaction d'Asinger est l'une des réactions multi-composants classée comme A-4CR (abréviation de "Asinger-4 component reaction") : du soufre élémentaire, une cétone ou un aldéhyde α-substitué, un autre composant avec un groupe carbonyle et de l'ammoniac forment avec un bon rendement une 3-thiazoline[2] ou des mélanges de plusieurs 3-thiazolines :


Mécanisme[modifier | modifier le code]
Le mécanisme expliqué sur une cétone est identique pour un aldéhyde (R3=H).
Première étape :
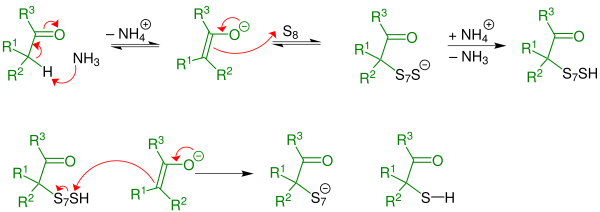
Une réaction de thiolation forme un intermédiaire α-mercaptocétone : L'α-thiolation est catalysée par une base - ici l'ammoniac- qui déprotone l'atome d'hydrogène en α de la cétone. La réaction est initiée par un énolate. Un cycle S8 du soufre élémentaire s'additionne sur la double liaison de l'énolate puis par protonation et réaction avec un autre énolate, forme une α-mercaptocétone et un polysulfure avec un soufre en moins qui par protonation et réaction avec d'autres énolates successivement forme de l'α-mercaptocétone jusqu'à ce qu'il soit lui-même une α-mercaptocétone.
Deuxième étape :

L'α-mercaptocétone réagit de manière irréversible avec un aldéhyde et de l'ammoniac pour former une 3-thiazoline : L'aldéhyde est ici l'autre composé carbonyle dans la réaction de cyclisation. Il s'agit d'une α-amino-alkylation d'un atome du carbone lié à S et O et donc polarisé et, pour encore plus de stabilisation, d'une cyclisation concertée avec le départ d'une molécule d'eau. Finalement une seconde déshydratation transforme la 3-thiazolidine en 3-thiazoline.
La formation de 3-thiazolines se produit également à l'aide d'α-thioaldéhyde ou d'α-thiocétone et d'ammoniac, ce qui revient à supprimer la première étape du mécanisme[3].
Variante[modifier | modifier le code]
Une version plus simple de la réaction d'Asinger a été développée par la société Degussa AG. La réaction d'un composant carbonyle α-halogéné avec l'hydrogénosulfure de sodium, NaHS génère in situ le composant α-mercapto-carbonyle (α-thiol) qui peut réagir directement avec des aldéhydes ou des cétones et de l'ammoniac pour donner des 3-thiazolines[4] :

Dans l'industrie chimique, des procédés multi-composés basés sur cette variante de l'A-4CR (synthèse d'Asinger à 4 composants) ont été développés pour la production de produits pharmaceutiques tels que le médicament D-pénicillamine[5] et l'acide aminé DL-cystéine[6] :

La synthèse de 3-oxazolines (analogues oxygénés des 3-thiazolines) peut être réalisée via une autre variante de la réaction d'Asinger avec un 2-halogénoaldéhyde, de l'ammoniac, de l'hydroxyde de sodium, NaOH et un autre composé carbonyle, en général une cétone[7].
Notes et références[modifier | modifier le code]
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Asinger-Reaktion » (voir la liste des auteurs).
- (de) F. Asinger, « Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone », Angew. Chem., vol. 68, no 12, , p. 413 (ISSN 1433-7851, DOI 10.1002/ange.19560681209).
- (de) R. Beckert, Organikum : organisch-chemisches Grundpraktikum, Weinheim (Allemagne), Wiley-VCH-Verlag, , 23e éd., 861 p. (ISBN 978-3-527-32292-3), chap. D6 (« Oxidation und Dehydrierung »), p. 434.
- (de) F. Asinger et M. Thiel, « Einfache Synthesen und chemisches Verhalten neuer heterocyclischer Ringsysteme », Angew. Chem., vol. 70, nos 22-23, , p. 667–683 (ISSN 1433-7851, DOI 10.1002/ange.19580702202).
- (en) K. Drauz, H. G. Koban et al., « Phosphonic and Phosphinic Acid Analogs of Penicillamine », Liebigs Ann. Chem., vol. 1985, no 3, , p. 448–452 (ISSN 1433-7851, DOI 10.1002/jlac.198519850303).
- (en) W. M. Weigert, H. Offermanns et al., « D-Penicillamine—Production and Properties », Angew. Chem. Int. Ed., vol. 14, no 5, , p. 330–336 (ISSN 1433-7851, DOI 10.1002/anie.197503301).
- (en) J. Martens, H. Offermanns et al., « Facile Synthesis of Racemic Cysteine », Angew. Chem. Int. Ed., vol. 20, no 8, , p. 668 (ISSN 1433-7851, DOI 10.1002/anie.198106681).
- (de) M. Weber, J. Jakob et al., « Synthese und Reaktivität von 3-Oxazolinen », Liebigs Ann. Chem., vol. 1992, no 1, , p. 1-6 (ISSN 1433-7851, DOI 10.1002/jlac.199219920102).
Bibliographie[modifier | modifier le code]
- Friedrich Asinger, Chemiker-Treffen Salzburg: Über die einfache und ergiebige Synthese von Thiazolinen., Angewandte Chemie, 1956, vol. 68, pp. 376–389. DOI 10.1002/ange.19560681109.
- Friedrich Asinger, Über die gemeinsame Einwirkung von Schwefel und Ammoniak auf Ketone., Angewandte Chemie, 1956, vol. 68, pp. 413–413. DOI 10.1002/ange.19560681209.
- Imre Schlemminger, Hans-Hermann Janknecht, Wolfgang Maison, Wolfgang Saak, Juergen Martens, Synthesis of the first enantiomerically pure 3-thiazolines via Asinger reaction., Tetrahedron Letters, 2000, vol. 41, pp. 7289–7292.DOI 10.1016/S0040-4039(00)01266-1.
- Jürgen Martens, Hans-Herrmann Janknecht, Synthese von 2-tert-Butyl-3-thiazolinen und Untersuchungen zur Diastereoselektivität der Asinger-Reaktion., Sulfur Letters, 1990, vol. 11, pp. 263–270.
