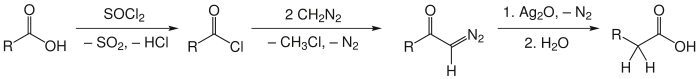Réaction d'Arndt-Eistert
La réaction d'Arndt-Eistert ou synthèse d'Arndt-Eistert est un ensemble de réactions chimiques permettant de convertir un acide carboxylique en un homologue acide carboxylique supérieur (dont la chaine carbonée est plus longue d'un atome). Elle est considérée comme une réaction d'homologation[1],[2],[3].
Nommée d'après les chimistes allemands Fritz Arndt (1885 - 1969) et Bernd Eistert (1902 - 1978), la synthèse d'Arndt-Eistert est une méthode populaire pour produire des acides bêta-aminés à partir d'acides alpha-aminés.
Dans cette réaction, l'acide carboxylique transformé en chlorure d'acyle par action du chlorure de thionyle est mis à réagir avec le diazométhane pour donner une diazocétone. En présence d'un nucléophile (eau) et d'un catalyseur métallique (Ag2O), la diazocétone se transforme en l'acide homologue recherché[4],[5] :
Mécanisme réactionnel[modifier | modifier le code]
L'étape clé de cette synthèse est le réarrangement de Wolff catalysé par un métal de la diazocétone pour former un cétène[6].
Le mécanisme ci dessous décrit l'homologation d'insertion de la (S)-phénylalanine (acide 2-amino-3-phénylpropanoïque) t-BOC protégée dans laquelle l'acide (S)-3-amino-4-phénylbutanoïque t-BOC protégé est formé[5] :
Le réarrangement de Wolff[7],[8] de l'intermédiaire α-diazocétone forme un cétène qui est par la suite hydrolysé pour former l'acide carboxylique. La conséquence de ce réarrangement 1,2 est le transfert du groupe méthylène du réactif diazométhane en α du groupe carboxyle. Il a été démontré que ce réarrangement préserve la stéréochimie du centre chiral car le produit formé à partir de la (S)-phénylalanine conserve sa stéréochimie (S) avec un excès énantiomérique d'au moins 99 %[5].
La chaleur, la lumière, les sels de platine, d'argent et de cuivre peuvent aussi catalyser le réarrangement de Wolff pour produire l'acide homologue désiré.
Remarques[modifier | modifier le code]
Si la synthèse d'Arndt-Eistert « classique » utilise le chlorure de thionyle pour convertir l'acide de départ en chlorure d'acyle, il est possible d'utiliser n'importe quelle procédure pour générer un chlorure d'acyle.
Cette réaction génère typiquement un intermédiaire diazocétone, mais d'autre méthodes, comme le transfert d'un groupe diazo[9].
Comme le diazométhane est toxique et violemment explosif, de nombreuses autres possibilités plus sûres ont été développées[10], comme l'utilisation d'ynolates (homologation d'ester de Kowalski)[11] ou de triméthylsilyldiazométhane[12],[13].
Variantes[modifier | modifier le code]
Dans la modification de Newman-Beal, l'addition de triéthylamine à la solution de diazométhane empêche la formation de produits secondaires α-chlorométhylcétone[14].
Notes et références[modifier | modifier le code]
- (de) F. Arndt et B. Eistert, « Ein Verfahren zur Überführung von Carbonsäuren in ihre höheren Homologen bzw. deren Derivate », Ber. Dtsch. Chem. Ges., vol. 68, no 1, , p. 200–208 (DOI 10.1002/cber.19350680142)
- (en) W. E. Bachmann et W. S. Struve, « The Arndt-Eistert Reaction », Org. React., vol. 1, , p. 38
- (en) T. Ye et M. A. McKervey, « Organic Synthesis with α-Diazo Carbonyl Compounds », Chem. Rev., vol. 94, no 4, , p. 1091–1160 (DOI 10.1021/cr00028a010)
- Ethyl 1-Naphthylacetate, Org. Synth. 50, coll. « vol. 6 », , p. 613
- (S)-3-(tert-Butyloxycarbonylamino)-4-phenylbutanoic acid, Org. Synth. 79, coll. « vol. 10 », , p. 194
- (en) C. Huggett, R. T. Arnold et T. I. Taylor, « The Mechanism of the Arndt-Eistert Reaction », J. Amer. Chem. Soc., vol. 64, no 12, , p. 3043 (DOI 10.1021/ja01264a505)
- (en) Meier, H. et Zeller, K.-P., « The Wolff Rearrangement of α-Diazo Carbonyl Compounds », Angew. Chem. Int. Ed., vol. 14, no 1, , p. 32–43 (DOI 10.1002/anie.197500321)
- (en) Kirmse, W., « 100 Years of the Wolff Rearrangement », European Journal of Organic Chemistry, vol. 2002, no 14, , p. 2193–2256 (DOI 10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D)
- Detrifluoroacetylative Diazo Group Transfer: (E)-1-Diazo-4-phenyl-3-buten-2-one, Org. Synth. 73, coll. « vol. 9 », , 134 p., p. 197
- (en) Katritzky, A. R., Zhang, S., Hussein, A. H. M., Fang, Y. et Steel, P. J., « One-Carbon Homologation of Carboxylic Acids via BtCH2TMS: A Safe Alternative to the Arndt−Eistert Reaction », J. Org. Chem., vol. 66, no 16, , p. 5606–5612 (DOI 10.1021/jo0017640)
- Ethyl 1-Naphthylacetate: Ester Homologation Via Ynolate Anions, Org. Synth. 71, coll. « vol. 9 », , 146 p., p. 426
- (en) Aoyama, T. et Shiori, T., « New Methods and Reagents in Organic Synthesis. 8. Trimethylsilyldiazomethane. A New, Stable, and Safe Reagent for the Classical Arndt-Eistert Synthesis », Tetrahedron Lett., vol. 21, no 46, , p. 4461–4462 (DOI 10.1016/S0040-4039(00)92200-7)
- J. Cesar et M. S. Dolenc, « Trimethylsilyldiazomethane in the Preparation of Diazoketones via Mixed Anhydride and Coupling Reagent Methods: a New Approach to the Arndt–Eistert Synthesis », Tetrahedron Lett., vol. 42, no 40, , p. 7099–7102 (DOI 10.1016/S0040-4039(01)01458-7)
- M. S. Newman et Philip F. Beal, « An Improved Wolff Rearrangement in Homogeneous Medium », J. Amer. Chem. Soc., vol. 72, no 11, , p. 5163–5165 (DOI 10.1021/ja01167a101)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Arndt–Eistert reaction » (voir la liste des auteurs).