Chlorure de fluorénylméthoxycarbonyle
| Chlorure de fluorénylméthoxycarbonyle | |||
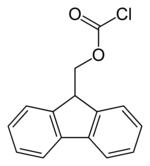 Structure du Fmoc-Cl |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.044.816 | ||
| No CE | 249-313-6 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C15H11ClO2 [Isomères] |
||
| Masse molaire[1] | 258,7 ± 0,015 g/mol C 69,64 %, H 4,29 %, Cl 13,7 %, O 12,37 %, |
||
| Précautions | |||
| SGH[2] | |||
| H301, H314, H318, H331, P260, P301+P310, P303+P361+P353, P305+P351+P338 et P405 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le chlorure de fluorénylméthoxycarbonyle est un ester de chloroformiate utilisé en synthèse organique pour introduire des groupes protecteurs Fmoc pour les amines, notamment lors de synthèses de peptides, par exemple[3] :
L'autre façon d'introduire un groupe Fmoc consiste à faire réagir du N-(9-fluorénylméthoxycarbonyloxy)-succinimide (Fmoc-OSu), qui peut quant à lui être obtenu en faisant réagir du Fmoc-Cl avec un sel de N-hydroxysuccinimide[4].
On peut produire chlorure de fluorénylméthoxycarbonyle en faisant réagir du 9-fluorénylméthanol avec du phosgène[5] :
Il peut être clivé par des bases, typiquement par une solution de pipéridine :
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- 9-Fluorenylmethyl chloroformate, 98% sur le site d'Alfa Aesar
- (en) Kazuhiko Yamada, Daisuke Hashizume, Tadashi Shimizu, Shinobu Ohki et Shigeyuki Yokoyama, « A solid-state 17O NMR, X-ray, and quantum chemical study of N-α-Fmoc-protected amino acids », Journal of Molecular Structure, vol. 888, nos 1-3, , p. 187-196 (DOI 10.1016/j.molstruc.2007.11.059, lire en ligne)
- (en) Alenka Paquet, « Introduction of 9-fluorenylmethyloxycarbonyl, trichloroethoxycarbonyl, and benzyloxycarbonyl amine protecting groups into O-unprotected hydroxyamino acids using succinimidyl carbonates », Revue canadienne de chimie, vol. 60, no 8, , p. 976-980 (DOI 10.1139/v82-146, lire en ligne)
- (en) Louis A. Carpino et Grace Y. Han, « 9-Fluorenylmethoxycarbonyl amino-protecting group », Journal of Organic Chemistry, vol. 37, no 22, , p. 3404-3409 (DOI 10.1021/jo00795a005, lire en ligne)






