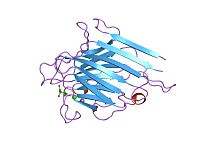
Lectine de légumineuses
Les lectines de légumineuses sont une famille de protéines liant des sucres, ou lectines, se trouvant dans les graines des Fabaceae, et en plus petite quantité, dans l'ensemble de ces plantes[2],[3]. La famille est aussi appelée couramment « légumineuses » (Leguminosae) ou Papilionacées (Papilionaceae), mais ce ne sont pas de vrais synonymes. La fonction précise des lectines de légumineuses in vivo n'est pas connue mais on les suppose impliquées dans la défense des plantes contre leurs prédateurs en perturbant le fonctionnement de leur tube digestif[4]. Des protéines similaires ont été trouvées dans d'autres familles de plantes et d'animaux. Elles sont utilisées depuis des décennies dans les études des systèmes d'interactions protéines-glucides, parce qu'elles montrent une extraordinaire variété de sites récepteurs-ligants et qu'elles sont faciles à purifier. Depuis des années, une quantité impressionnante de données structurelles ont ainsi été accumulées[3]. Les protéines particulièrement bien étudiées sont celles de la famille des phytohémagglutinine et des concanavaline A (hémagglutinines).
Liaisons des glucides par les lectines légumineuses
Les lectines légumineuses ont une capacité originale pour se lier aux glucides. Elle exploite la possibilité d'occuper un récepteur du glucide pour lequel quatre résidus de quatre régions de la protéine ont une affinité (voir schéma), cette boucle variable donne la spécificité du glucide et aussi un autre nombre de sous-récepteurs du glucide situés autour du récepteur principal qui a aussi des résidus sucres additionnels ou groupes hydrophobes[3].
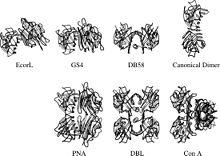
Structure quaternaire
Les lectines légumineuses sont intéressantes aussi du point de vue de la structure de la protéine. Malgré le fait que les sous-unités de la lectine de légumineuse conservent leur structure, elles peuvent adopter nombre de structures quaternaires[5],[6]. La raison derrière cette remarquable variété provient probablement des interactions multiples des ligants multivalents[7].
 |
 |
Références
- (en) Loris R, Casset F, Bouckaert J, et al., « The monosaccharide binding site of lentil lectin: an X-ray and molecular modelling study », Glycoconj. J., vol. 11, no 6, , p. 507–17 (PMID 7696853)
- (en) Sharon N, Lis H, « Legume lectins--a large family of homologous proteins », FASEB J., vol. 4, no 14, , p. 3198–208 (PMID 2227211)
- (en) Loris R, Hamelryck T, Bouckaert J, Wyns L, « Legume lectin structure », Biochim. Biophys. Acta, vol. 1383, no 1, , p. 9–36 (PMID 9546043, DOI 10.1016/S0167-4838(97)00182-9)
- (en) Andreas Schaller, Induced Plant Resistance to Herbivory, Springer Science & Business Media, , p. 291
- (en) Manoj N, Suguna K, « Signature of quaternary structure in the sequences of legume lectins », Protein Eng., vol. 14, no 10, , p. 735–45 (PMID 11739891)
- PDBe Browser for legume lectin assemblies
- (en) Hamelryck TW, Moore JG, Chrispeels MJ, Loris R, Wyns L., « The role of weak protein-protein interactions in multivalent lectin-carbohydrate binding: crystal structure of cross-linked FRIL. », J.Mol.Biol., vol. 299, no 4, , p. 875–83 (PMID 10843844, DOI 10.1006/jmbi.2000.3785, lire en ligne)