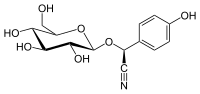
Dhurrine
| Dhurrine | |
| |
| Identification | |
|---|---|
| Nom UICPA | (2S)-2-(4-hydroxyphényl)-2-[[(2R,3R,4S,5S,6R)-3,4,5-trihydroxy-6-(hydroxyméthyl)-2-tétrahydropyranyl]oxy]acétonitrile |
| Synonymes |
(S)-4-hydroxymandelnitrile-β-D-glucopyranoside, (S)-(β-D-glucopyranosyloxy)(4-hydroxyphényl)acétonitrile |
| No CAS | |
| No ECHA | 100.007.163 |
| No CE | 207-878-6 |
| PubChem | 161355 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H17NO7 [Isomères] |
| Masse molaire[1] | 311,287 3 ± 0,014 7 g/mol C 54,02 %, H 5,5 %, N 4,5 %, O 35,98 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La dhurrine est un glucoside cyanogène produit par diverses espèces de plantes de la famille des Poaceae (notamment les sorghos) et des Proteaceae. Découverte chez plusieurs variétés de sorgho cultivé en 1906 et identifiée comme responsable d'intoxications du bétail par le cyanure d'hydrogène, la dhurrine est le plus souvent associée au Sorghum bicolor[2], utilisé en tant qu'organisme modèle pour cartographier la biosynthèse de la dhurrine à partir de la tyrosine. Le terme « dhurrine » est dérivé du mot arabe désignant le sorgho, translittéré sous la forme « dhura ».
Biosynthèse[modifier | modifier le code]
Régulation chez Sorghum bicolor[modifier | modifier le code]
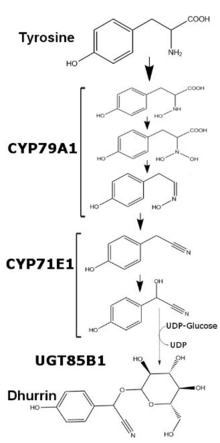
Chez Sorghum bicolor , la production de dhurrine est régulée au niveau transcriptionnel et varie en fonction de l'âge de la plante et des nutriments disponibles. La teneur en dhurrine chez Sorghum bicolor peut être corrélée à la quantité d'ARNm et des enzymes CYP79A1 et CYP71E1, deux molécules de liaison des membranes de la superfamille du cytochrome P450. Alors que la transcription et la traduction de ces deux enzymes est relativement plus élevée pendant les premiers jours de croissance, elles sont considérablement réduites après la première semaine de croissance. Après cinq semaines de croissance, la transcription et la traduction des deux enzymes deviennent indétectables dans les feuilles, tandis que les tiges de ces plantes maintiennent une production minimale des deux enzymes. En cas d'apports excessifs de nitrates, la transcription des deux enzymes augmente, mais pas aux niveaux observés au début du développement[3]. La dernière enzyme intervenant dans la synthèse de la dhurrine, l'uridine diphosphoglucose-glucosyltransférase (UGT85B1), est une enzyme soluble qui transfère le glucose de l'uridine diphosphate glucose (UDP-glucose) vers l'aglycone de la dhurrine et forme la liaison glucosidique.
Synthèse transgénique[modifier | modifier le code]
On a démontré que l'insertion des gènes CYP79A1 et CYP71E1 dans le génome d'Arabidopsis thaliana et de Nicotiana tabacum est suffisante pour provoquer la synthèse de dhurrine chez ces plantes[4]. La présence de ces deux enzymes est une condition suffisante et nécessaire pour la synthèse de la dhurrine, car l'élimination du gène CYP79A1 du génome de Sorghum bicolor conduit à des plantes dépourvues de dhurrine. Cette souche ainsi modifiée pourrait théoriquement être utilisée pour cultiver un fourrage plus sûr dans les régions de climat aride où le sorgho est le seul grain disponible. La biosynthèse in vitro de la dhurrine a été réalisée à la fois dans les microsomes récupérés sur des plantules de sorgho bicolor et dans les micelles[5].
Toxicité[modifier | modifier le code]
Mammifères[modifier | modifier le code]
L'intestin des mammifères contient de multiples glucosidases qui hydrolysent efficacement les liaisons glucosidiques. Lors de l'hydrolyse de la liaison glucosidique, l'aglycone de la dhurrine se dégrade rapidement pour former du cyanure d'hydrogène qui est ensuite absorbé dans la circulation sanguine. La dose létale de dhurrine chez l'homme et chez d'autres mammifères est théoriquement élevée car chaque molécule de dhurrine ne produit qu'une molécule de cyanure d'hydrogène. La teneur du sorgho en dhurrine est relativement faible par rapport à la matière végétale totale. Il faudrait, pour un être humain, consommer une quantité considérable de sorgho cru avant de ressentir des effets indésirables. Dans les milieux arides, la culture du sorgho est la meilleure solution pour produire des grains ou du fourrage car cette plante peut résister à des conditions de sécheresse extrême[6]. Les animaux qui consomment du sorgho brut en tant que fourrage sont beaucoup plus susceptibles d'en ingérer une quantité qui contiendrait une dose létale de dhurrine pour leurs espèces respectives et cela peut entraîner la perte d'animaux par intoxication au cyanure d'hydrogène.
Répulsif contre les insectes[modifier | modifier le code]
En réponse aux attaques externes sur les tiges, les variétés de sorgho peuvent libérer de la dhurrine sur les sites endommagés. On a démontré que cette réaction repoussait les insectes car les variétés de sorgho transgéniques transformées pour inhiber la synthèse de la dhurrine sont beaucoup plus attaquées par les insectes que les variétés de sorgho de type sauvage[7].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dhurrin » (voir la liste des auteurs).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Émile Miège, « Toxicité des Sorghos », sur Persée, (consulté le ).
