Acétyllysine
| N6-Acétyl-L-lysine | |
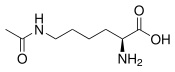
| |
| Structure de la N6-acétyl-L-lysine | |
| Identification | |
|---|---|
| Nom UICPA | N6-acétyl-L-lysine |
| Synonymes |
N-ε-acétyl-L-lysine |
| No CAS | |
| No ECHA | 100.010.661 |
| No CE | 211-725-9 |
| PubChem | 92832 |
| ChEBI | 17752 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H16N2O3 [Isomères] |
| Masse molaire[1] | 188,224 2 ± 0,008 8 g/mol C 51,05 %, H 8,57 %, N 14,88 %, O 25,5 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acétyllysine est un dérivé acétylé de la lysine, dont l'énantiomère L ou S(+) est un acide aminé protéinogène. Il en existe deux isomères :
- la N2-acétyllysine dans laquelle le groupe acétyle est lié à l'amine du carbone α de la lysine ;
- la N6-acétyllysine dans laquelle le groupe acétyle est lié à l'amine du carbone ε de la lysine.
La N6-acétyl-L-lysine peut se former dans certaines protéines par modification post-traductionnelle d'un résidu de lysine. Il s'agit d'un important mécanisme épigénétique agissant sur la liaison des histones à l'ADN dans les nucléosomes, ce qui a pour effet de moduler l'expression des gènes dans les chromosomes. Les histones ne sont pas les seules protéines à être acétylées. À la différence des méthyllysines, qui lui sont fonctionnellement semblables, l'acétyllysine ne porte pas de charge électrique positive sur sa chaîne latérale.
Les histone acétyltransférases (HAT) sont des enzymes qui catalysent l'acétylation de certains résidus de lysine de protéines telles que les histones à partir de l'acétyl-CoA ; les histone désacétylases (HDAC) catalysent la réaction réciproque de clivage du groupe acétyle des résidus d'acétyllysine.
L'acétyllysine peut être produite in vitro par acétylation sélective de l'amine primaire située à l'extrémité de la chaîne latérale de la lysine sous l'effet du N-méthoxydiacétamide[2] H3C–CO–N(OCH3)–CO–CH3.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yasuo Kikugawa, Kimiyo Mitsui, Takeshi Sakamoto, Masami Kawase et Hiroshi Tamiya, « N-methoxydiacetamide: A new selective acetylating agent », Tetrahedron Letters, vol. 31, no 2, , p. 243-246 (DOI 10.1016/S0040-4039(00)94382-X, lire en ligne)
