2-Méthylundécanal
| 2-Méthylundécanal | |

| |
| Identification | |
|---|---|
| Nom UICPA | 2-Méthylundécanal |
| Nom systématique | 2-Méthylundécanal |
| No CAS | |
| No ECHA | 100.003.424 |
| No CE | 203-765-0 |
| No RTECS | YQ1509000 |
| PubChem | 61031 6915922 (2R) 637522 (2S) |
| SMILES | |
| InChI | |
| Apparence | liquide incolore[1] |
| Propriétés chimiques | |
| Formule | C12H24O [Isomères] |
| Masse molaire[2] | 184,318 4 ± 0,011 6 g/mol C 78,2 %, H 13,12 %, O 8,68 %, |
| Propriétés physiques | |
| T° fusion | < −50 °C[1] |
| T° ébullition | 231 °C[1] |
| Solubilité | 1,3 g·L-1 (eau, )[1] |
| Masse volumique | 0,828 g·cm-3 (20 °C)[1] |
| Point d’éclair | 68,5 °C (coupelle fermée)[1] |
| Pression de vapeur saturante | 0,85 hPa (20 °C)[1] |
| Viscosité dynamique | |
| Viscosité cinématique | 3,3 mm2 s−1 (20 °C)[1] 2,2 mm2 s−1 (40 °C)[1] |
| Précautions | |
| SGH[1] | |
| H315, H317, H410, P272, P273, P280, P362, P302+P352 et P333+P313 |
|
| Transport[1] | |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|

Le 2-méthylundécanal est un composé organique de formule C12H24O de la famille des aldéhydes gras. Naturellement présent dans l'huile d"écorce de kumquat[3], il se présente sous la forme d'un liquide incolore à jaune pâle légèrement visqueux[1], avec une odeur herbacée, d'orange, et d'ambre gris[4] ce qui fait qu'il utilisé en parfumerie et dans l'industrie des détergents et des savons. À haute dilution, il a une saveur semblable à celle du miel et des noix[3].
Propriétés[modifier | modifier le code]
Le 2-méthylundécanal se présente sous la orme d'un liquide incolore à jaune pâle légèrement visqueux[1] très peu soluble dans l'eau mais soluble dans les solvants organiques tels que l'éther et l'éthanol[5]. Il est combustible mais peu inflammable (point d'éclair de 68,5 °C[1]). Il est peu à très peu volatil, mais ses vapeurs peuvent former des mélanges explosifs avec l'air lorsqu'il est chauffé au-dessus de son point d'éclair. Il présente des risques aigus ou chroniques pour la santé, et il est dangereux pour la vie aquatique[1].
Chiralité[modifier | modifier le code]
Le 2-méthylundécanal possède un carbone asymétrique, le carbone 2, et est par conséquent chiral et existe donc sous la forme de deux énantiomères.
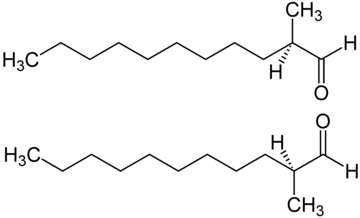
Les deux énantiomères ont des propriété similaires, et des tests effectué avec un parfumeur professionnel n'ont noté qu'une légère différence de qualité et d'intensité olfactive entre les deux[6].
Synthèse[modifier | modifier le code]
La première synthèse du 2-méthylundécanal à partir de l'undécan-2-one et du chloroacétate d'éthyle fut rapportée par Auguste Darzens en 1904[7]. Cette méthode de synthèse permettant de produire une large variété d'aldéhydes est toujours employée aujourd'hui et est connue sous le nom de réaction de Darzens. Dans le cas du 2-méthylundécanal, elle implique la conversion de l'undécan-2-one en son glycidate par réaction avec un chloroacétate d'alkyle. Le glycidate subit ensuite une saponification suivie d'une décarboxylation[8] :
- CH3(CH2)8C(O)CH3 + ClCH2CO2R → CH3(CH2)8CH(CH3)OCH(CO2R) + HCl
- CH3(CH2)8CCH3OCCO2R + H2O → CH3(CH2)8CH(CH3)CHO + CO2 + ROH
Une seconde méthode de synthèse du 2-méthylundecanal part du dec-1-éne qui est hydroformylé en undécanal. Ce dernier est ensuite converti en 2-méthylèneundécanal en le faisant réagir avec le formaldéhyde en présence de base ; cette conversion un rendement supérieur à 50 %. Enfin, la double liaison du 2-méthylèneundécanal est hydrogénée pour donner le 2-méthylundécanal, qui doit être séparé des sous-produits par distillation fractionnée[8].
- CH3(CH2)7CH2=CH2 + H2 + CO → CH3(CH2)10CHO
- CH3(CH2)10CHO + HCHO → CH3(CH2)8C(CH2)CHO + H2O
- CH3(CH2)8C(CH2)CHO + H2 → CH3(CH2)8CH(CH3)CHO
Il est également possible de synthétiser un énantiomère voulu avec une grande pureté énantiomérique par la méthode d'hydrazone SAMP/RAMP (en). Ce procédé part d'un aldéhyde achiral qui est ensuite converti en hydrazone de SAMP ou RAMP équivalent, en utilisant respectivement la (S)-1-amino-2-méthoxymethylpyrrolidine (SAMP) ou la (R)-1-amino-2-méthoxyméthylpyrrolidine (RAMP) comme auxiliaire chiral. L'hydrazone chirale ainsi formée est ensuite métalée par le diisopropylamidure de lithium (LDA) puis alkylée par du sulfate de diméthyle en léger excès, alkylation dont l'orientation dépendra de celle du groupe méthoxyméthylpyrrolidine attaché.
Applications[modifier | modifier le code]
Le 2-méthylundécanal est largement utilisé comme élément de parfum dans les savons et les détergents ainsi que dans l'industrie de la parfumerie pour donner des notes de conifère, de sapin en particulier, mais il est également utilisé dans des compositions « fantasy »[8]. Le 2-méthylundécanal est également le premier composé synthétique a être utilisé dans un parfum de luxe, le Chanel No. 5[9].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 2-Methylundecanal » (voir la liste des auteurs).
- Entrée « 2-Methylundecanal » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2023-12-02 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Giovanni Fenorali, Fenorali's Handbook of Flavor Ingredients, Boca Raton, CRC Press, , 5th éd.
- Molecule of the Month: Chanel No 5 and 2-methylundecanal
- CRC Handbook of Chemistry and Physics, CRC Press, 2008–2009, 89th éd.
- Hubert Dyker, Synthesis and Properties of Enantiomers of the Two Artificial Fragrances Lilial and Methylundecanal,
- Georges Darzens, Comptes Rendus Hebdomadaires des séances de l'Académie des Sciences,
- Ullmann's Encyclopedia of Industrial Chemistry, Hoboken, John Wiley & Sons Inc., , 7th éd.
- E.N. Ramsden, A-Level Chemistry, UK, Nelson Thornes, , 4th éd.
Bibliographie[modifier | modifier le code]
- Burdock, George A., Fenorali, Giovanni. Fenorali’s Handbook of Flavor Ingredients, 5e ed.; CRC Press: Boca Raton, 2004. (ISBN 0-8493-3034-3)
- Ullmann’s Encyclopedia of Industrial Chemistry 7e Ed: Fragrances and Flavors, John Wiley & Sons Inc, Hoboken 2009 (DOI 10.1002/14356007.a11_141).
- CRC Handbook of Chemistry and Physics. 89e ed. 2008-2009.
- Darzens, Georges, Comptes Rendus Hebdomadaires des séances de l’Académie des Sciences, 1904, 139, 1214-1217.
- Dieter Enders, Hubert Dyker, Synthesis and Properties of Enantiomers of the Two Artificial Fragrances Lilial and Methylundecanal. Institut für Organische Chemie der Rheinisch-Westfälischen Technischen Hochschule. 1990, 1107–1110 (DOI 10.1002/jlac.1990199001200).
- Ramsden, E. N. A-Level Chemistry. 4th ed. Nelson Thornes: UK, 2000.




