Hybridation (chimie)
En chimie quantique, l'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de manière à former de nouvelles orbitales qui permettent de mieux décrire qualitativement les liaisons entre atomes. Les orbitales hybrides sont très utiles pour expliquer la forme des orbitales moléculaires. Bien que parfois enseignées avec la théorie VSEPR (Valence Shell Electron Pair Repulsion), liaison de valence et hybridation sont en fait indépendantes du VSEPR.
Exemple du méthane[modifier | modifier le code]
La théorie des orbitales hybrides a été développée par Linus Pauling pour expliquer la géométrie de molécules comme le méthane (CH4). La difficulté de compréhension de cette dernière a pour cause les raisons suivantes. Il s'agit d'une molécule constituée d'un atome de carbone lié à quatre atomes d'hydrogène. La configuration électronique de l'atome de carbone dans son état fondamental est 1s22s22p2, soit :
L'orbitale atomique 1s est plus basse en énergie que l'orbitale 2s, cette dernière étant elle-même plus basse en énergie que les orbitales 2p. Les trois orbitales 2px, 2py et 2pz étant dégénérées en énergie, les deux électrons s'y répartissent aléatoirement.
De prime abord, il semblerait que l'atome de carbone ne doive former que deux liaisons covalentes du fait de l'existence de deux orbitales 2p à moitié remplies. Cependant CH2, le méthylène, est instable et réagit facilement pour venir s'ajouter comme groupement à l'intérieur de molécules. Ce raisonnement ne permet pas d'expliquer l'existence du méthane.
Par ailleurs un raisonnement impliquant un état excité ne permettrait pas d'expliquer les propriétés du méthane. Si un électron de l'orbitale 2s est excité et occupe l'orbitale 2pz, le carbone peut alors être lié à quatre atomes d'hydrogène (quatre orbitales du carbone sont à moitié remplies). Cependant, la forme des orbitales 2s et 2p étant très différentes, le recouvrement avec les orbitales des différents atomes d'hydrogène sera différent, et les quatre liaisons C-H n'auront pas la même énergie, ce qui est contraire aux résultats expérimentaux.
L'hybridation[modifier | modifier le code]
Une manière de répondre au problème de l'existence et de la géométrie de ce type de molécule est l'hybridation des orbitales atomiques. Historiquement, ce concept est apparu pour expliquer les liaisons chimiques dans des systèmes très simples (comme le méthane). Il s'est avéré ensuite que cette théorie est applicable plus largement et elle fait aujourd'hui partie des bases de la compréhension de la chimie organique. Elle est moins facilement applicable aux branches de la chimie pour lesquelles sont mis en jeu des atomes lourds. La théorie de l'hybridation pour la chimie des éléments de transition est plus compliquée et conduit à des résultats nettement moins précis.
Les orbitales (orbitales atomiques, orbitales hybrides ou orbitales moléculaires) constituent un modèle représentant la manière dont les électrons se comportent autour des noyaux atomiques. Dans le cas de l'hybridation, le modèle est basé sur les orbitales atomiques de l'hydrogène. Les orbitales hybrides sont des mélanges de ces orbitales atomiques où elles se recouvrent en différentes proportions. Les orbitales atomiques utilisées comme base sont celles de l'hydrogène car il s'agit du seul cas pour lequel il est possible de résoudre exactement l'équation de Schrödinger. Les orbitales obtenues sont alors légèrement déformées dans les atomes plus lourds comme le carbone, l'azote et l'oxygène.
La première étape dans la construction des orbitales hybrides est l'excitation d'un (ou plusieurs) électron(s). Pour simplifier, la suite du texte traite plus particulièrement de l'exemple de la molécule de méthane. Le proton constituant le noyau d'un atome d'hydrogène attire l'un des électrons de valence du carbone. Celui-ci occupe alors un état excité, avec un électron 2s occupant une orbitale 2p. En conséquence, l'influence du noyau de l'atome de carbone sur les électrons de valence augmente du fait de l'augmentation de la charge effective (charge effectivement ressentie par les électrons : elle est égale à la charge du noyau diminuée de l'écrantage causé par les autres électrons). La combinaison de ces forces (attraction par le noyau d'hydrogène et modification de l'attraction par le noyau de carbone) conduit à de nouvelles fonctions mathématiques, les orbitales hybrides. Dans le cas de l'atome de carbone lié à quatre atomes d'hydrogène, il se crée quatre nouvelles orbitales : l'orbitale 2s se mélange avec les trois orbitales 2p pour former quatre orbitales hybrides sp3. L'atome de carbone excité :
devient :

Schéma 1 : Diagramme décrivant l'hybridation des orbitales 2s et 2p en orbitales sp, sp2 et sp3.
Le schéma 1 illustre les différentes hybridations possibles pour un atome de carbone excité et leur configuration électronique. À noter que l'énergie des orbitales hybrides est, conservation de l'énergie oblige, la moyenne pondérée des orbitales 2s et 2p utilisées mais ceci ne vaut que dans un cas idéal. Pour les orbitales sp3, on utilise une seule orbitale s et trois orbitales p, d'où : Esp3 = (Es + 3Ep) / 4 ; en revanche, une orbitale sp utilise une orbitale s et une orbitale p et l'on obtient Esp = (Es + Ep) / 2.
Orbitales hybrides et géométrie des molécules[modifier | modifier le code]
Forme des orbitales sp, sp2 et sp3[modifier | modifier le code]
Dans le cas idéal, les orbitales adoptent la géométrie la plus symétrique possible ; d'ailleurs la symétrie est l'un des principaux facteurs induisant la dégénérescence des niveaux d'énergie, comme c'est le cas pour les orbitales hybrides qui ont toute la même énergie.
| sp3 | sp2 | sp |
|---|---|---|
 |
 |
 |
| Tétraèdre régulier (3D) | Triangle (2D) | Linéaire (1D) |
- Tableau 1 : Forme idéale des orbitales hybrides sp, sp2 et sp3.
Évidemment, il faut ajouter les orbitales p restantes. Là encore, les orbitales adoptent la plus haute symétrie possible :
À gauche, les trois orbitales sp2 (en gris) et l'orbitale p restante (en vert) ; à droite, les deux orbitales sp (en gris) et les deux orbitales p restantes (en bleu et vert).
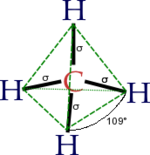
Pour le méthane, la forme tétraédrique adoptée par les orbitales sp3 explique la géométrie du méthane.

Un autre exemple d'hybridation sp2 est l'azote de la pyridine où deux des trois orbitales sp2 (formées de px, py et σ) contiennent un électron (liaison sigma avec les atomes de carbone adjacents) et où la dernière comporte 2 électrons (d'où le doublet non liant).
La structure des autres molécules organiques s'explique de manière similaire. Par exemple dans l'éthylène, les orbitales atomiques du carbone se mélangent pour former des orbitales hybrides sp2, et le recouvrement entre les atomes de carbone et avec ceux d'hydrogène conduit à la formation de deux liaisons C-H de type sigma et à une double liaison C-C (liaison de type σ superposée par une liaison de type π).
La pz comporte un autre électron participant aux liaisons π de la molécule.
La proportion de caractère p n'est pas restreinte à des valeurs entières, et il existe par exemple des orbitales hybrides sp2.5. Dans ce cas, la géométrie est déformée par rapport aux orbitales hybrides « idéales ». D'après la règle de Bent, le caractère p d'une liaison est d'autant plus grand qu'elle est dirigée vers un élément plus électronégatif.
Forme des molécules[modifier | modifier le code]
L'hybridation des orbitales permet d'expliquer qualitativement la géométrie des molécules :

| Type de molécule | Hybridation spx | Hybridation sdx | Hybridation spxdy |
|---|---|---|---|
| Groupe principal/ métaux de transition |
Métaux de transition uniquement | ||
| AX2 |
|
||
| AX3 |
|
|
|
| AX4 |
|
|
|
| AX6 |
|
| |
| Angles interorbitaires | |||
Pour les molécules hypervalentes, la liaison est controversée et difficile à expliquer. En fait, les calculs de la chimie quantique ont montré que les éléments du groupe principal n'utilisent pas les orbitales d. Ces molécules utilisent la mésomérie.
| AX5 | Bipyramidale trigonale |
|---|---|

| |
| AX6 | Octaédrique |

| |
| AX7 | Bipyramidale pentagonale |

|
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Orbital hybridisation » (voir la liste des auteurs).
Sources[modifier | modifier le code]
- (en) L. Pauling, J. Am. Chem. Soc., 53 (1931), 1367.
- (en) L. Pauling, The Nature of the Chemical Bond, Cornell University Press (ISBN 0-8014-0333-2).
- (en) Clayden, Greeves, Warren et Wothers, Organic Chemistry, Oxford University Press (2001) (ISBN 0-19-850346-6).
- (en) H. A. Bent, Chem. Rev., 68 (1968), 587-648.
- (en) Weinhold, Frank et Landis, Clark R., Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective, Cambridge University Press (2005) (ISBN 0-521-83128-8).
- (en) Craig Bayse et Michael Hall, Prediction of the Geometries of Simple Transition Metal Polyhydride Complexes by Symmetry Analysis, J. Am. Chem. Soc., 121 (1999), 1348–1358.
- (en) David L. Cooper, Terry P. Cunningham, Joseph Gerratt, Peter B. Karadakov et Mario Raimondi, Chemical Bonding to Hypercoordinate Second-Row Atoms: d Orbital Participation versus Democracy, J. Am. Chem. Soc., 116 (1994), 4414–4426.







