Chémostat
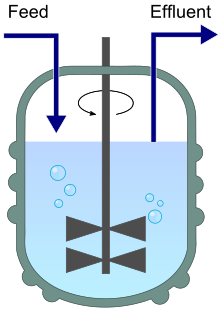

Un chémostat (contraction de "environnement chimique qui reste statique") est un bioréacteur dans lequel du milieu frais est ajouté en continu, tandis que le liquide de culture contenant les nutriments restants, les produits finaux métaboliques et les micro-organismes est éliminé en continu à la même vitesse pour maintenir le volume de culture constant[2],[3]. En modifiant la vitesse à laquelle le milieu est ajouté au bioréacteur, la vitesse de croissance spécifique du micro-organisme peut être facilement contrôlée dans certaines limites.
Fonctionnement[modifier | modifier le code]
Régime permanent[modifier | modifier le code]
L'une des caractéristiques les plus importantes des chémostats est que les micro-organismes peuvent y être cultivés dans un état physiologique stable en conditions environnementales constantes. Dans cet état d'équilibre, la croissance se produit à un taux de croissance spécifique constant et tous les paramètres de culture restent constants (volume de culture, concentration en oxygène dissous, concentrations en nutriments et en produits, pH, densité cellulaire, etc). De plus, les conditions environnementales peuvent être contrôlées par l'expérimentateur[4]. Les micro-organismes qui se développent dans les chémostats atteignent généralement un état d'équilibre en raison d'une rétroaction négative entre le taux de croissance et la consommation de nutriments : si un faible nombre de cellules sont présentes dans le bioréacteur, les cellules peuvent croître à des taux de croissance supérieurs au taux de dilution car elles consomment peu de nutriments. La croissance est donc moins limitée par l'ajout d'un nutriment limitant dans le milieu frais entrant. Le nutriment limitant est un nutriment essentiel à la croissance, présent dans le milieu à une concentration limite (tous les autres nutriments sont généralement apportés en excédent). Cependant, plus le nombre de cellules augmente, plus le nutriment est consommé, ce qui diminue la concentration du nutriment limitant. À son tour, cela réduira le taux de croissance spécifique des cellules, ce qui entraînera une diminution du nombre de cellules à mesure qu'elles continueront d'être retirées du système avec l'écoulement. Il en résulte un "état d'équilibre", ou régime permanent (steady state en anglais). En raison de l'autorégulation, l'état stationnaire est stable. Cela permet à l'expérimentateur de contrôler le taux de croissance spécifique des micro-organismes en modifiant la vitesse de la pompe alimentant le milieu frais dans le récipient.
Homogénéité[modifier | modifier le code]
Une autre caractéristique importante des chémostats et autres systèmes de culture continue est qu'ils sont bien mélangés, de sorte que les conditions environnementales soient homogènes ou uniformes et que les micro-organismes soient dispersés au hasard et se rencontrent au hasard. Par conséquent, la compétition et les autres interactions dans le chémostat sont globales et non locales, contrairement aux biofilms.
Taux de dilution[modifier | modifier le code]
Le taux d'échange de nutriments est exprimé comme le taux de dilution D. À l'état d'équilibre, le taux de croissance spécifique μ du micro-organisme est égal au taux de dilution D. Le taux de dilution est défini comme le débit de milieu par unité de temps F, sur le volume V de culture dans le bioréacteur.
Taux de croissance maximal et taux de dilution critique[modifier | modifier le code]
Le taux de croissance spécifique μ est inversement proportionnel au temps nécessaire à la biomasse pour doubler, appelé temps de doublement td :
Par conséquent, le temps de doublement td devient une fonction du taux de dilution D en régime permanent :
Chaque micro-organisme poussant sur un substrat particulier a un taux de croissance spécifique maximal μmax (le taux de croissance observé si la croissance est limitée par des contraintes internes plutôt que par des nutriments externes). Si un taux de dilution supérieur à μmax est choisi, les cellules ne peuvent pas croître à une vitesse aussi rapide que la vitesse à laquelle elles sont retirées, de sorte que la culture ne pourra pas se maintenir dans le bioréacteur et sera éliminée dans l'effluent.
Cependant, étant donné que la concentration du nutriment limitant dans le chémostat ne peut pas dépasser la concentration dans le milieu affluent, le taux de croissance spécifique que les cellules peuvent atteindre dans le chémostat est généralement légèrement inférieur au taux de croissance spécifique maximal, car le taux de croissance spécifique augmente généralement avec la concentration en nutriments, tel que décrite par la cinétique de l'équation de Monod[5]. Les taux de croissance spécifiques les plus élevés (μmax) que les cellules peuvent atteindre sont égaux au taux de dilution critique (D'c) :
où S est le substrat ou la concentration en nutriments dans le chémostat, et KS est la constante de demi-saturation (cette équation suppose une cinétique de Monod).
Applications[modifier | modifier le code]
Recherche[modifier | modifier le code]
En recherche scientifique, les chémostats sont utilisés pour des études en biologie cellulaire, lorsque l'on a besoin d'utiliser de grands volumes de cellules ou de protéines uniformes. Le chémostat est souvent utilisé pour recueillir des données sur l'état d'équilibre d'un organisme afin de générer un modèle mathématique relatif à ses processus métaboliques. Les chémostats sont également utilisés comme microcosmes en écologie[6],[7] et en biologie évolutive[8],[9],[10],[11]. Dans un cas, la mutation/sélection est une nuisance, dans l'autre cas, c'est le processus souhaité qui est étudié. Les chémostats peuvent également être utilisés pour enrichir des types spécifiques de mutants bactériens en culture tels que les auxotrophes ou ceux qui sont résistants aux antibiotiques ou aux bactériophages pour une étude scientifique plus approfondie[12]. Les variations du taux de dilution permettent d'étudier les stratégies métaboliques poursuivies par les organismes à différents taux de croissance[13],[14].
La compétition pour les ressources uniques et multiples, l'évolution des voies d'acquisition et d'utilisation des ressources, le cross-feeding et la symbiose[15],[16], l'antagonisme, la prédation et la compétition entre prédateurs sont autant de processus ayant été étudiés en écologie et en biologie évolutive à l'aide de chémostats[17],[18],[19].
Industrie[modifier | modifier le code]
Les chémostats sont fréquemment utilisés dans la fabrication industrielle d'éthanol. Dans ce cas, plusieurs chémostats sont utilisés en série, chacun maintenu à des concentrations décroissantes en sucre[20]. Le chémostat sert également de modèle expérimental pour les cultures cellulaires continues dans l'industrie biotechnologique[14].
Préoccupations techniques[modifier | modifier le code]
- Le moussage entraîne un débordement avec un volume de liquide pas exactement constant.
- Certaines cellules très fragiles peuvent être détruites lors de l'agitation et de l'aération.
- Les cellules peuvent se développer sur les parois ou adhérer à d'autres surfaces[21], ce qui peut être résolu en traitant les parois de verre du récipient avec un silane pour les rendre hydrophobes. Cependant, les cellules seront sélectionnées (au fil des générations) pour être capables de s'attacher aux parois rendues hydrophobes, puisque celles qui pourront potentiellement développer cette capacité ne seront pas éliminées du système. Ces bactéries qui adhèrent fermement aux parois formant un biofilm sont difficiles à étudier dans des conditions de chémostat.
- Le mélange peut ne pas être vraiment uniforme, affectant la propriété dite "statique" du chémostat.
- L'égouttement du milieu dans le réacteur entraîne en fait de petites impulsions de nutriments et donc des oscillations de concentrations, affectant à nouveau la propriété "statique" du chémostat.
- Les bactéries voyagent assez facilement vers la source d'affluent. Elles atteindront rapidement le réservoir de milieu stérile, à moins que le trajet du liquide ne soit interrompu par une coupure d'air dans laquelle le milieu tombe goutte à goutte dans la partie aérienne du réacteur.
Des efforts continus pour remédier à chaque défaut conduisent à des variations assez régulières du modèle basique du chémostat. Les exemples illustrant ces améliorations sont nombreux dans la littérature.
- Des agents anti-mousse sont utilisés pour supprimer la formation de mousse.
- L'agitation et l'aération peuvent se faire de façon plus douce.
- De nombreuses approches ont été adoptées pour réduire la croissance sur les parois[22],[23].
- Diverses applications utilisent des sortes d'aubes, des bulles ou d'autres mécanismes pour mélanger[24].
- L'égouttement peut être rendu moins drastique avec des gouttelettes plus petites et des volumes de réacteur plus grands.
- De nombreuses améliorations ciblent la menace de contamination.
Considérations relatives à la conception expérimentale[modifier | modifier le code]
Choix et configuration des paramètres[25][modifier | modifier le code]
- La concentration à l'état d'équilibre du substrat limitant dans le chémostat est indépendante de la concentration de l'influx. La concentration de l'influx affectera la concentration cellulaire et donc la densité optique (DO) à l'état d'équilibre.
- Même si la concentration de substrat limite dans le chémostat est généralement très faible et est maintenue par des impulsions d'influx discrètes hautement concentrées, en pratique, la variation temporelle de la concentration dans le chémostat est faible (quelques pour cent ou moins) et peut donc être considérée comme état quasi-stationnaire.
- Le temps nécessaire à la (DO) pour converger vers une valeur d'état d'équilibre (dépassement/sous-dépassement) sera souvent long (renouvellements multiples de chémostats), en particulier lorsque l'inoculum initial est important. Mais ce temps peut être minimisé avec un choix de paramètres approprié.
Croissance à l'état d'équilibre[25][modifier | modifier le code]
- Un chémostat peut sembler être dans un état stable, mais des prises de contrôle par des souches mutantes peuvent se produire en continu, même si elles ne sont pas détectables en surveillant des paramètres à grande échelle comme la DO ou les concentrations de produits.
- Le substrat limitant est généralement à des concentrations si faibles qu'il est indétectable. En conséquence, la concentration du substrat limitant peut varier considérablement au fil du temps (en pourcentage) à mesure que différentes souches envahissent la population, même si les changements résultants de la DO sont trop faibles pour être détectés.
- Un chémostat en mode "pulse" (avec de très grandes impulsions d'influx) a une capacité sélective sensiblement inférieure à un chémostat quasi-continu standard, pour une souche mutante avec une aptitude accrue dans des conditions limitantes.
- En abaissant brusquement la concentration de substrat limitant l'influx, il est possible de soumettre temporairement les cellules à des conditions relativement plus dures, jusqu'à ce que le chémostat se stabilise à l'état d'équilibre (sur l'ordre temporel du taux de dilution D).
Mutation[modifier | modifier le code]
- Certains types de souches mutantes apparaîtront rapidement.
- S'il existe un SNP qui peut augmenter l'aptitude, il devrait apparaître dans la population après seulement quelques doublements de chémostat, pour des chémostats typiquement grands (par exemple 1011 cellules d'E. coli).
- Une souche qui nécessite deux SNP spécifiques où seule leur combinaison donne un avantage sélectif (alors que chacun pris séparément est neutre), est susceptible d'apparaître uniquement si la taille cible (le nombre d'emplacements différents de SNP qui donnent lieu à une mutation avantageuse) pour chaque SNP est très grande.
- D'autres types de souches mutantes (par exemple, deux SNP avec une petite taille cible, plus de SNP ou dans des chémostats plus petits) sont très peu susceptibles d'apparaître.
- Ces autres mutations ne sont attendues que par balayages successifs de mutants ayant un avantage sélectif. On ne peut s'attendre à ce que plusieurs mutants apparaissent que si chaque mutation est indépendamment bénéfique, et non dans les cas où les mutations sont individuellement neutres mais ensemble avantageuses. Les prises de contrôle successives sont le seul moyen fiable pour que l'évolution puisse suivre son cours dans un chémostat.
- Le scénario apparemment extrême il est exigé que tous les SNP possibles coexistent au moins une fois dans le chémostat est en fait assez probable. Un grand chémostat est très susceptible d'atteindre cet état.
- Pour un grand chémostat, le temps prévu jusqu'à ce qu'une mutation avantageuse se produise est de l'ordre du temps de renouvellement du chémostat. À noter que cela est généralement beaucoup plus court que le temps nécessaire à une souche avantageuse pour prendre en charge la population chémostatique. Ce n'est pas nécessairement le cas dans un petit chémostat.
- Les points ci-dessus devraient être applicables à différentes espèces à reproduction asexuée (E. coli, S. cerevisiae, etc).
- De plus, le temps jusqu'à l'apparition de la mutation est indépendant de la taille du génome, mais dépend du taux de mutation par paire de bases.
- Pour les chémostats de taille caractéristique, une souche hyper-mutante ne donne pas suffisamment d'avantages pour justifier son utilisation. De plus, elle n'a pas suffisamment d'avantage sélectif pour qu'on s'attende à ce qu'elle apparaisse toujours par mutation aléatoire et prenne le relais du chémostat.
Prise de contrôle unique[modifier | modifier le code]
- Le temps de prise de contrôle est prévisible compte tenu des paramètres de souche pertinents.
- Différents taux de dilution favorisent sélectivement différentes souches mutantes pour prendre contrôle de la population du chémostat, si une telle souche existe. Par exemple :
- Un taux de dilution rapide crée une pression de sélection pour une souche mutante avec un taux de croissance maximal élevé.
- Un taux de dilution moyen crée une pression de sélection pour une souche mutante avec une affinité plus élevée pour le substrat limitant.
- Un taux de dilution lent crée une pression de sélection pour une souche mutante qui peut se développer dans un milieu sans substrat limitant (vraisemblablement en consommant un substrat différent présent dans le milieu).
- Le temps de prise de contrôle d'un mutant supérieur sera assez constant sur une gamme de paramètres de fonctionnement. Pour les valeurs de fonctionnement caractéristiques, le temps de prise en charge est de l'ordre de quelques jours à quelques semaines.
Prises de contrôle successives[modifier | modifier le code]
- Lorsque les conditions sont réunies (une population suffisamment importante et plusieurs cibles dans le génome pour de simples mutations avantageuses), plusieurs souches devraient successivement prendre le contrôle de la population, et ce de manière relativement chronométrée et rythmée. Le moment dépend du type de mutations.
- Dans une succession de prises de contrôle, même si l'amélioration sélective de chacune des souches reste constante (par exemple, chaque nouvelle souche est meilleure que la souche précédente d'un facteur constant), le taux de prise de contrôle ne reste pas constant, mais diminue plutôt de souche en souche.
- Il existe des cas où les prises de contrôle successives se produisent si rapidement qu'il est très difficile de différencier les souches, même en examinant la fréquence des allèles. Ainsi, une lignée de multiples prises de contrôle de souches consécutives pourrait apparaître comme la prise de contrôle d'une seule souche avec une cohorte de mutations.
Variantes[modifier | modifier le code]
Il existe des réacteurs de fermentation inspirés des chémostats comme le turbidostat, l'auxostat, le ségrégostat[26] et le rétentostat. Dans les rétentostats, le liquide de culture est également retiré du bioréacteur, mais un filtre retient la biomasse. Dans ce cas, la concentration de la biomasse augmente jusqu'à ce que les besoins en éléments nutritifs pour le maintien de la biomasse soient devenus égaux à la quantité d'éléments nutritifs limitants qui peuvent être consommés.
Voir aussi[modifier | modifier le code]
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chemostat » (voir la liste des auteurs).
- Michael Madigan, Brock Biology of Microorganisms, Pearson, , 152–153 p. (ISBN 978-0-321-89739-8)
- « Description of the Chemostat », Science, vol. 112, no 2920, , p. 715–6 (PMID 14787503, DOI 10.1126/science.112.2920.715, Bibcode 1950Sci...112..715N)
- James TW, « Continuous Culture of Microorganisms », Annual Review of Microbiology, vol. 15, , p. 27–46 (DOI 10.1146/annurev.mi.15.100161.000331)
- D Herbert, R Elsworth et RC Telling, « The continuous culture of bacteria; a theoretical and experimental study », J. Gen. Microbiol., vol. 14, no 3, , p. 601–622 (PMID 13346021, DOI 10.1099/00221287-14-3-601)
- T. B. Young, D. F. Bruley et H. R. Bungay, « A dynamic mathematical model of the chemostat », Biotechnology and Bioengineering, vol. 12, no 5, , p. 747–769 (ISSN 0006-3592 et 1097-0290, DOI 10.1002/bit.260120506, lire en ligne, consulté le )
- « Experimental demonstration of chaos in a microbial food web », Nature, vol. 435, no 7046, , p. 1226–9 (PMID 15988524, DOI 10.1038/nature03627, Bibcode 2005Natur.435.1226B)
- « Microbial predation in a periodically operated chemostat: a global study of the interaction between natural and externally imposed frequencies », Math Biosci, vol. 108, no 1, , p. 1–55 (PMID 1550993, DOI 10.1016/0025-5564(92)90002-E)
- « Adaptive Molecular Evolution for 13,000 Phage Generations: A Possible Arms Race », Genetics, vol. 170, no 1, , p. 19–31 (PMID 15687276, PMCID 1449705, DOI 10.1534/genetics.104.034488)
- « Evolution of specialists in an experimental microcosm », Genetics, vol. 167, no 4, , p. 2015–26 (PMID 15342537, PMCID 1470984, DOI 10.1534/genetics.103.025205)
- « The apparent clock-like evolution of Escherichia coli in glucose-limited chemostats is reproducible at large but not at small population sizes and can be explained with Monod kinetics », Microbiology, vol. 148, no Pt 9, , p. 2889–902 (PMID 12213934, DOI 10.1099/00221287-148-9-2889)
- « Effects of rapid prey evolution on predator-prey cycles », J Math Biol, vol. 55, no 4, , p. 541–73 (PMID 17483952, DOI 10.1007/s00285-007-0094-6, arXiv q-bio/0609032)
- « Enrichment cultures », Annu. Rev. Microbiol., vol. 21, , p. 49–70 (PMID 4860267, DOI 10.1146/annurev.mi.21.100167.000405)
- (en) Varma et Palsson, « Stoichiometric flux balance models quantitatively predict growth and metabolic by-product secretion in wild-type Escherichia coli W3110. », Applied and Environmental Microbiology, vol. 60, no 10, , p. 3724–3731 (ISSN 0099-2240, PMID 7986045, PMCID 201879, DOI 10.1128/aem.60.10.3724-3731.1994, Bibcode 1994ApEnM..60.3724V)
- Jorge Fernandez-de-Cossio-Diaz, Kalet Leon et Roberto Mulet, « Characterizing steady states of genome-scale metabolic networks in continuous cell cultures », PLoS computational biology, vol. 13, no 11, , e1005835 (ISSN 1553-7358, PMID 29131817, PMCID 5703580, DOI 10.1371/journal.pcbi.1005835, lire en ligne, consulté le )
- « Parathion utilization by bacterial symbionts in a chemostat », Appl. Environ. Microbiol., vol. 34, no 2, , p. 175–84 (PMID 410368, PMCID 242618, DOI 10.1128/aem.34.2.175-184.1977, Bibcode 1977ApEnM..34..175D)
- « Evolution of cross-feeding in microbial populations », Am. Nat., vol. 163, no 6, , E126–35 (PMID 15266392, DOI 10.1086/383593)
- G. J. Butler et G. S. K. Wolkowicz, « Predator-mediated competition in the chemostat », J Math Biol, vol. 24, no 2, , p. 67–191 (DOI 10.1007/BF00275997)
- « Selection in chemostats », Microbiol. Rev., vol. 47, no 2, , p. 150–68 (PMID 6308409, PMCID 281569, DOI 10.1128/mr.47.2.150-168.1983)
- « Evolution of Competitive Ability in Escherichia coli », Evolution, vol. 35, no 3, , p. 581–94 (PMID 28563589, DOI 10.2307/2408204, JSTOR 2408204)
- (en) S. Schorr-Galindo, C. Ghommidh et J. P. Guiraud, « Simultaneous production of sugars and ethanol from inulin rich-extracts in a chemostat », Biotechnology Letters, vol. 17, no 6, , p. 655–658 (ISSN 1573-6776, DOI 10.1007/BF00129395, lire en ligne, consulté le )
- « Protozoan feeding and bacterial wall growth », Biotechnol. Bioeng., vol. 18, no 2, , p. 239–52 (PMID 1267931, DOI 10.1002/bit.260180209)
- « Development of a novel continuous culture device for experimental evolution of bacterial populations », Appl. Microbiol. Biotechnol., vol. 77, no 2, , p. 489–96 (PMID 17896105, DOI 10.1007/s00253-007-1168-5)
- « Microchemostat-microbial continuous culture in a polymer-based, instrumented microbioreactor », Lab Chip, vol. 6, no 7, , p. 906–13 (PMID 16804595, DOI 10.1039/b518396k)
- « Practical experiences with start-up and operation of a continuously aerated lab-scale SHARON reactor », Commun. Agric. Appl. Biol. Sci., vol. 68, no 2 Pt A, , p. 77–84 (PMID 15296140)
- Aryeh Wides et Ron Milo, « Understanding the Dynamics and Optimizing the Performance of Chemostat Selection Experiments », arXiv:1806.00272 [q-bio], (lire en ligne, consulté le )
- (en) Hosni Sassi, Thai Minh Nguyen, Samuel Telek et Guillermo Gosset, « Segregostat: a novel concept to control phenotypic diversification dynamics on the example of Gram‐negative bacteria », Microbial Biotechnology, vol. 12, no 5, , p. 1064–1075 (ISSN 1751-7915 et 1751-7915, PMID 31141840, PMCID PMC6680609, DOI 10.1111/1751-7915.13442, lire en ligne, consulté le )
Liens externes[modifier | modifier le code]
- http://www.pererikstrandberg.se/examensarbete/chemostat.pdf
- https://web.archive.org/web/20060504172359/http://www.rpi.edu/dept/chem-eng/Biotech-Environ/Contin/chemosta.htm
- Une thèse finale incluant des modèles mathématiques du chémostat et d'autres bioréacteurs
- Une page sur une conception de chimiostat de laboratoire
- Manuel de chémostat complet (laboratoire Dunham). Les procédures et les principes sont généraux.




