« Nitrure d'hafnium » : différence entre les versions
Création de la page. |
(Aucune différence)
|
Version du 9 août 2020 à 23:15
| Nitrure d'hafnium | |
| |
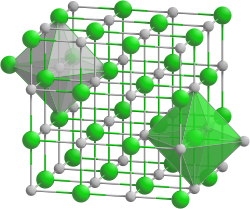
| __ Hf3+ __ N3– Structure cristalline du nitrure d'hafnium |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.042.970 |
| No CE | 247-282-3 |
| Propriétés chimiques | |
| Formule | HfN |
| Masse molaire[1] | 192,5 ± 0,02 g/mol Hf 92,72 %, N 7,28 %, |
| Propriétés physiques | |
| T° fusion | 3 305 °C[2] |
| Masse volumique | 11,7 g·cm-3[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le nitrure d'hafnium est un composé chimique de formule HfN. Il se présente sous la forme d'un solide inodore gris foncé à jaune-brun. Il s'agit d'un matériau superdur réfractaire[4] ayant une dureté Vickers de 46 GPa[5]. C'est un conducteur électrique de structure cristalline de type halite ayant le groupe d'espace Fm3m (no 225)[6]. Sa masse volumique expérimentale n'est que de 11,70 g/cm3 alors qu'elle serait théoriquement plutôt 13,39 g/cm3 sur la base de sa structure cristalline[3].
Le nitrure d'hafnium est utilisé comme matériau de pulvérisation pour augmenter la stabilité des diodes, des transistors et des circuits intégrés[4]. On l'utilise également comme matériau de revêtement sur les outils de tour[7] en raison de sa dureté et de sa très grande stabilité thermique, avec un point de fusion particulièrement élevé[8].
On peut obtenir le nitrure d'hafnium avec des méthodes semblables à celles du nitrure de titane[9]. Il est ainsi possible de l'obtenir à partir des éléments hafnium et azote entre 1 400 et 1 500 °C :
On peut également l'obtenir par croissance à partir de tétrachlorure d'hafnium HfCl4 à 2 900 °C dans l'azote pur ou à une température plus basse (de 2 000 à 2 400 °C) en présence d'hydrogène (mélange H2 + N2, ou ammoniac NH3). L'hydrogène a également pour effet d'accélérer la vitesse de croissance du nitrure d'hafnium[9].
Sous des pressions élevées, l'ammonolyse ou la réaction du nitrure d'hafnium avec l'azote forme un nitrure d'hafnium de formule Hf3N4 de type Th3P4 cubique avec le groupe d'espace I43d.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Roger Blachnik, Taschenbuch für Chemiker und Physiker, vol. III, « Elemente, anorganische Verbindungen und Materialien, Minerale », 4e éd. révisée, Springer, Berlin, 1998, p. 479. (ISBN 3-540-60035-3)
- (de) M. E. Straumanis et C. A. Faunce, « Der unvollkommene Aufbau des Hafniumnitrids und das Bindungsproblem », Zeitschrift für anorganische und allgemeine Chemie, vol. 353, nos 5-6, , p. 329-336 (DOI 10.1002/zaac.19673530514, lire en ligne)
- (en) Dale L. Perry, Handbook of Inorganic Compounds, 2e éd., Taylor & Francis, 2011, p. 194. (ISBN 1439814627)
- (en) Derya Deniz, Texture evolution in metal nitride (aluminum nitride, titanium nitride, hafnium nitride) thin films prepared by off-normal incidence reactive magnetron sputtering, ProQuest, 2008, {{p.|6]]. (ISBN 9781109037821)
- (en) Werner Martienssen, Hans Warlimont, Springer Handbook of Condensed Matter and Materials Data, Springer, 2005, p. 468. (ISBN 9783540304371)
- (de) Serope Kalpakjian, Steven R. Schmid et Ewald Werner, Werkstofftechnik, Pearson Deutschland GmbH, 2011, p. 634. (ISBN 978386894006-0)
- (en) H. M T. Bangalore, Production Technology, Tata McGraw-Hill Education, 2001, p. 41. (ISBN 9780070964433)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. II, Ferdinand Enke, Stuttgart, 1978, p. 1379. (ISBN 3-432-87813-3)
