Valeur A

Les valeurs A sont des valeurs numériques utilisées pour déterminer l'orientation la plus stable des atomes dans une molécule ( analyse conformationnelle ), ainsi qu'une représentation générale de encombrement stérique. Les valeurs A sont calculés à partir de mesures d'énergie des différentes conformations d'nu cyclohexane monosubstitué[1]. Les substituants sur un cycle cyclohexane préfèrent résider en position équatoriale par rapport à l'axial. La différence d'énergie libre de Gibbs (ΔG) entre la conformation d'énergie supérieure (substitution axiale) et la conformation d'énergie inférieure (substitution équatoriale) est la valeur A pour ce substituant particulier.
Utilité[modifier | modifier le code]
Les valeurs A aident à prédire la conformation des cycles cyclohexane. La conformation la plus stable sera celle qui possède le ou les substituants en position équatoriale. Lorsque plusieurs substituants sont pris en compte, la conformation où le substituant avec la plus grande valeur A est en position équatoriale est favorisée.

L'utilité des A-values peut être généralisée et pas uniquement réduites au cyclohexane et ses dérivés. Les valeurs A peuvent aider à prédire l’ effet stérique d’un substituant. En général, plus la valeur A d'un substituant est élevée, plus l'effet stérique de ce substituant est important. Un groupe méthyle a une valeur A de 1,74 tandis qu'un groupe tert -butyle a une valeur A d'environ 5. Étant donné que la valeur A du tert -butyle est plus élevée, le tert -butyle a un effet stérique plus important que le méthyle. Cette différence dans les effets stériques peut être utilisée pour aider à prédire la réactivité dans les réactions chimiques.
Considérations sur l'énergie libre[modifier | modifier le code]
Les effets stériques jouent un rôle majeur dans l'attribution des configurations dans les cyclohexanes. On peut raisonner sur les gênes stériques pour déterminer la propension d'un substituant à se trouver dans le plan axial ou équatorial. On sait que les liaisons axiales induisent une plus grande gêne stérique que les liaisons équatoriales correspondantes. En effet, les substituants en position axiale sont relativement proches de deux autres substituants axiaux provoquant un conflit stérique entre ces groupements. Ces types d'interactions stériques sont communément appelés interactions 1,3 diaxiales[2]. Ces types d'interactions ne sont pas présents avec les substituants en position équatoriale.
Il existe généralement trois contributions principales à l'énergie libre conformationnelle [3]:
- Déformation de Baeyer, définie comme la déformation résultant de la déformation des angles de liaison.
- La déformation de Pitzer, définie comme la déformation de torsion résultant de 1,2 interactions entre groupes attachés à des carbones contigus,
- Interactions de Van der Waals, qui sont similaires aux interactions 1,3 diaxiales.
Composants enthalpiques[modifier | modifier le code]
Lors de la comparaison de la stabilité relative, les interactions à 6 et 7 atomes peuvent être utilisées pour approximer les différences d'enthalpie entre les conformations. Chaque interaction de 6 atomes vaut 0,9 Kcal/mol (3,8 kJ/mol) et chaque interaction de 7 atomes vaut 4 kcal/mol (17kJ/mol)[4].
Composants entropiques[modifier | modifier le code]
L'entropie joue également un rôle dans la préférence d'un substituant pour la position équatoriale. La composante entropique est déterminée par la formule suivante :
Où σ est égal au nombre de microétats disponibles pour chaque conformation.

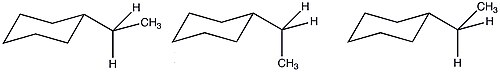
En raison du plus grand nombre de conformations possibles de l'éthylcyclohexane, la valeur A est réduite par rapport à ce qui serait prédit sur la base uniquement des termes enthalpiques. En raison de ces conditions entropiques favorables, la pertinence stérique d'un groupe éthyle est similaire à celle d'un substituant méthyle.
Tableau des A-values[modifier | modifier le code]
| Substituent | A-value | Substituent | A-value | Substituent | A-value | ||
|---|---|---|---|---|---|---|---|
| D | 0.006 | CH2Br | 1.79 | OSi(CH3)3 | 0.74 | ||
| F | 0.15 | CH(CH3)2 | 2.15 | OH | 0.87 | ||
| Cl | 0.43 | c-C6H11 | 2.15 | OCH3 | 0.6 | ||
| Br | 0.38 | C(CH3)3 | >4 | OCD3 | 0.56 | ||
| I | 0.43 | Ph | 3 | OCH2CH3 | 0.9 | ||
| CN | 0.17 | CO2H | 1.35 | O-Ac | 0.6 | ||
| NC | 0.21 | CO2− | 1.92 | O-TFA | 0.68 | ||
| NCO | 0.51 | CO2CH3 | 1.27 | OCHO | 0.27 | ||
| NCS | 0.28 | CO2Et | 1.2 | O-Ts | 0.5 | ||
| N=C=NR | 1 | CO2iPr | 0.96 | ONO2 | 0.59 | ||
| CH3 | 1.7 | COCl | 1.25 | NH2 | 1.6 | ||
| CF3 | 2.1 | COCH3 | 1.17 | NHCH3 | 1 | ||
| CH2CH3 | 1.75 | SH | 0.9 | N(CH3)2 | 2.1[9] | ||
| CH=CH2 | 1.35 | SMe | 0.7 | NH3+ | 1.9 | ||
| CCH | 0.41 | SPh | 0.8 | NO2 | 1.1 | ||
| CH2tBu | 2 | S− | 1.3 | HgBr | ~0 | ||
| CH2OTs | 1.75 | SOPh | 1.9 | HgCl | 0.3 | ||
| SO2Ph | 2.5 | Si(CH3)3 | 2.5 |
Applications[modifier | modifier le code]
L'une des expériences originales réalisées par Winston et Holness consistait à mesurer le taux d'oxydation dans les cycles substitués trans et cis à l'aide d'un catalyseur au chrome. Le groupe volumineux, tert -butyle utilisé verrouille la conformation de chaque molécule qui se trouve en position équatoriale.

Il a été observé que la réaction d'oxydation était plus rapide avec le conformère cis plutôt que le composé trans. L'explication proposée était que le groupe hydroxyle (considéré comme volumineux du fait de la présence de doublets non liants) en position axiale était défavorisé et formait plus facilement le carbonyle pour soulager cette tension. Le composé trans avait des taux identiques à ceux trouvés dans le cyclohexanol monosubstitué.

En utilisant les valeurs A des sous-unités hydroxyle et isopropyle, la valeur énergétique d’une liaison hydrogène intramoléculaire favorable peut être calculée[10].

Limites[modifier | modifier le code]
Les valeurs A sont mesurées à l'aide d'un cycle cyclohexane mono-substitué et indiquent uniquement les stériques qu'un substituant particulier confère à la molécule. Cela conduit à un problème lorsqu’il existe des facteurs électroniques stabilisants possibles dans un système différent. Le substituant acide carboxylique présenté ci-dessous est axial dans l’état fondamental, malgré une valeur A positive. De cette observation, il ressort clairement qu’il existe d’autres interactions électroniques possibles qui stabilisent la conformation axiale.

Autres considérations[modifier | modifier le code]
Il est important de noter que les valeurs A ne prédisent pas la taille physique d’une molécule, mais uniquement l’effet stérique. Par exemple, le groupe tert -butyle (valeur A = 4,9) a une valeur A plus grande que le groupe triméthylsilyle (valeur A = 2,5), mais le groupe tert -butyle occupe en réalité moins d'espace. Cette différence peut être attribuée à la longueur plus longue de la liaison carbone-silicium par rapport à la liaison carbone-carbone du groupe tert -butyle. La liaison plus longue permet moins d'interactions avec les substituants voisins, ce qui rend effectivement le groupe triméthylsilyle moins gênant stériquement, abaissant ainsi sa valeur A[2]. Cela peut également être constaté en comparant les halogènes. Le brome, l'iode et le chlore ont tous des valeurs A similaires même si leurs rayons atomiques diffèrent[4]. Les valeurs A prédisent alors la taille apparente d’un substituant, et les tailles apparentes relatives déterminent les différences d’effets stériques entre les composés. Ainsi, les valeurs A sont des outils utiles pour déterminer la réactivité des composés dans les réactions chimiques.
Notes et références[modifier | modifier le code]
- Muller, P, « Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994) », Pure and Applied Chemistry, vol. 66, no 5, , p. 1077–1184 (DOI 10.1351/pac199466051077, S2CID 195819485, lire en ligne)
- Robert V. Hoffman, Organic Chemistry, New Jersey, John Wiley and Sons, Inc., (ISBN 978-0-471-45024-5, lire en ligne), p. 167
- J. Edgar Anderson, Dynamic Chemistry, vol. 45, Springer-Verlag, coll. « Topics in Current Chemistry Fortschritte der Chemischen Forschung », (ISBN 978-3-540-06471-8, DOI 10.1007/3-540-06471-0), p. 139
- Eric V. Anslyn et Dennis A. Dougherty, Modern Physical Organic Chemistry, Sausalito, CA, University Science Books, , 104–105 (ISBN 978-1-891389-31-3, lire en ligne
 )
)
- E.L. Eliel, S.H. Wilen et L.N. Mander, Stereochemistry of Organic Compounds, New York, Wiley, (ISBN 81-224-0570-3)
- E.L. Eliel, N.L. Allinger, S.J. Angyal et Morrison G.A., Conformational Analysis, New York, Interscience Publishers,
- J. A. Hirsch, Topics in Stereochemistry, New York, first, , p. 199
- C. Romers, C. Altona, H. R. Buys et E. Havinga, Topics in Stereochemistry, New York, fourth, , p. 40
- « Table of A-Values » [archive du ], Advanced Organic Chemistry 330, University of British Colombia,
- Huang, C.-Y., Cabell, L.A. et Anslyn, E.V., « Molecular Recognition of Cyclitols by Neutral Polyaza-Hydrogen-Bonding Receptors: The Strength and Influence of Intramolecular Hydrogen Bonds between Vicinal Alcohols », Journal of the American Chemical Society, vol. 116, no 7, , p. 2778–2792 (DOI 10.1021/ja00086a011)




