Utilisateur:GoldenFork/Olfaction chez les insectes
L'olfaction chez les insectes fait référence aux fonctions de récepteurs chimiques qui permettent aux insectes de détecter et d'identifier des composés volatils aussi bien pour se nourrir, que pour éviter des prédateurs, trouver des partenaires d'accouplement (via les phéromones ) ou encore localiser des lieux de ponte[1] . C'est donc le plus important des sens pour les insectes.[1]
Les comportements princpaux des insectes , pour être adaptés, doivent être parfaitement synchronisés aux stimulis, ce qui dépend généralement de ce qu'ils sentent et du moment où ils le sentent[2].
À déplacer Par exemple, l'olfaction est essentielle pour localiser les plantes hôtes et chasser les proies de nombreuses espèces d'insectes, telles que la mite Deilephila elpenor ou la guêpe Polybia sericea.
Les deux principaux organes olfactifs présents chez les insectes sont les antennes et des pièces buccales spécialisées appelées palpes maxillaires[3]. -- fin RI
Créer une section dans laquelle on décrit :
1- les organes
Antennes
Palpes Maxillaires
Cependant, une étude récente a démontré un rôle olfactif de l'ovipositeur chez les guêpes du figuier[4].
2- Neurones:
À l'intérieur de ces organes olfactifs se trouvent des neurones appelés neurones récepteurs olfactifs qui, comme leur nom l'indique, abritent des récepteurs pour les molécules olfactives dans leur membrane cellulaire. La majorité des neurones récepteurs olfactifs résident généralement dans l' antenne . Ces neurones peuvent être très abondants ; par exemple, les mouches drosophiles ont 2 600 neurones sensoriels olfactifs.
Cependant, une étude récente a démontré un rôle olfactif de l'ovipositeur chez les guêpes du figuier[4],[3].
Section à déplacer après avant la cascade olfactive
Sensibilité et selectivité de l'olfaction[modifier | modifier le code]
Les insectes sont capables de sentir et de différencier des milliers de composés volatils de manière sensible et sélective[5],[6].
La sensibilité est la mesure dans laquelle l'insecte est sensible à de très petites quantités d'une substance odorante ou à de petits changements dans la concentration d'une substance odorante.
La sélectivité fait référence à la capacité des insectes à distinguer un odorant d'un autre.
Parmi les arthropodes hématophages, ces composés sont généralement divisés en trois classes : les acides carboxyliques à chaîne courte, les aldéhydes et les composés azotés de faible poids moléculaire[6].
Intérêt des insectes dans la modélistation de l'olfaction chez les vertébrés[modifier | modifier le code]
Les insectes ont été utilisés comme système modèle pour étudier l'olfaction des mammifères et surtout de l'homme.
Pourtant, contrairement aux vertébrés qui utilisent des récepteurs couplés aux protéines G ( GPCR ), les insectes expriment des protéines, notamment des OR ( récepteurs olfactifs ), des GR (récepteurs gustatifs) et des IR ( récepteurs ionotropes ), qui sont tous des canaux ioniques hétéromères ligand-dépendants.[3] Une espèce de papillon de nuit de l'ordre des lépidoptères connue sous le nom de ver-gris noir ( Agrotis ipsilon ) produit encore plus de protéines, notamment des OBP ( protéines de liaison aux odeurs ), des CSP (protéines de liaison chimiosensorielles) et des SNMP (protéines de membrane neuronale sensorielle) qui aident le papillon de nuit. reconnaître les phéromones sexuelles et les odorants tels que ceux libérés par les plantes hôtes.[7] Tout comme chez les vertébrés, les axones des neurones sensoriels convergent vers les glomérules, mais diffèrent par l'endroit où les glomérules sont logés. Chez les mammifères, ils sont situés dans les bulbes olfactifs, mais chez les insectes, ils se trouvent dans le lobe antennaire .
Histoire évolutive[modifier | modifier le code]
En elle-même, l'olfaction est une fonction métaboliquement coûteuse.
Encore plus coûteux sont les traits plus complexes qui lui sont associés.
Niven & Laughlin 2008 trouvent qu'une sensibilité olfactive élevée est énergétiquement coûteuse, et d'autres recherches ont montré que la capacité de modifier le comportement final résultant du stimulus l'est également. Les compromis évolutifs impliqués nécessitent une étude encore plus approfondie car en 2016 la plupart de ces recherches avaient été effectuées dans des conditions de laboratoire et avec des aliments d'une fiabilité irréaliste[8].
Cascade olfactive[modifier | modifier le code]
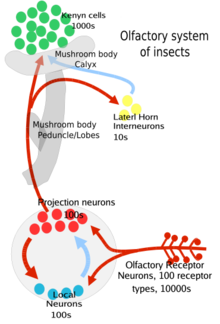
Les neurones sensoriels de l'antenne, du palpe maxillaire et du labelle génèrent des signaux électriques spécifiques aux odeurs appelés pointes ( potentiels d'action ) en réponse à la liaison des odeurs aux protéines de surface cellulaire comme les récepteurs olfactifs . Les neurones sensoriels de l'antenne et du maxillaire envoient ces informations via leurs axones au lobe antennaire[9], tandis que les neurones sensoriels de la labelle envoient ces informations via des axones au ganglion sous-œsophagien[10] . À l'intérieur du lobe antennaire, ils synapsent avec d'autres neurones dans des structures semi-délimitées (avec des limites membranaires) appelées glomérules .
Plus précisément, le processus est le suivant : d'abord, l'odorant se dirige vers l'antenne d'un insecte ou le palpe maxillaire qui est recouvert de projections ressemblant à des cheveux appelées sensilla[6] . L'odorant pénètre ensuite par de minuscules pores dans l'exosquelette (ou cuticule) de cette sensille et se diffuse dans le fluide entre les cellules appelé fluides extracellulaires[1] . Là, la molécule odorante se lie à une protéine de liaison odorante qui la transporte vers une équipe récepteur[1] et co-récepteur (Orco) à la surface du neurone récepteur olfactif (ORN)[1],[3]. Cela conduit le neurone à déclencher un potentiel d'action dans l'axone[2]. Ce signal est envoyé au lobe antennaire ou au ganglion sous-œsophagien du cerveau de l'insecte où il peut ensuite intégrer l'information avec d'autres signaux provenant d'autres sensilles .
Ces ORN sont bipolaires, à une extrémité se trouvent les dendrites olfactives avec les récepteurs des odeurs et à l'autre extrémité se trouvent les axones qui transportent le potentiel d'action vers le lobe antennaire du cerveau[3]. Les lobes antennaires ont deux types de neurones, les neurones de projection (principalement excitateurs) et les neurones locaux (inhibiteurs, avec quelques excitateurs). Les neurones de projection envoient leurs terminaisons axonales à une partie du cerveau de l'insecte appelée corps de champignon (importante pour la régulation des réponses olfactives apprises) et à une autre partie du cerveau appelée corne latérale (importante pour la régulation des réponses olfactives innées[3] ). Ces deux régions font partie du protocerebrum du cerveau de l'insecte.
Méthodes de recherche[modifier | modifier le code]
Les enregistrements de potentiel d'action sont effectués de trois manières différentes : électroanténogrammes, électropalpogrammes et enregistrements de sensille unique (SSR)[6]. Dans les électroanténogrammes (EAG) et les électropalpogrammes (EPG), les potentiels d'action de l'ensemble de l'antenne ou du palpe maxillaire, respectivement, sont enregistrés. Les EAG et EPG fournissent une vue d'ensemble de l'olfaction dans l'organe respectif.[6] Au cours d'une SSR, une électrode est insérée dans une seule sensille et l'enregistrement est effectué uniquement à partir des ORN contenus dans cette sensille, fournissant des informations plus détaillées[6] .
Chacune de ces méthodes peut être combinée avec une chromatographie en phase gazeuse à haute résolution pour isoler les composés volatils d'animaux ou d'habitats importants.[6] Par exemple, cette méthode pourrait être utilisée pour déterminer quel composé d'une fleur particulière est le plus attrayant pour une abeille. Les enregistrements des neurones de projection montrent que chez certains insectes, il existe une forte spécialisation et discrimination pour les odeurs présentées par les ORN. Cela est particulièrement vrai pour les neurones de projection des macroglomérules, un complexe spécialisé de glomérules responsable de la détection des phéromones.
Répulsifs et attractifs[modifier | modifier le code]
Les humains exploitent le système olfactif des insectes pour contrôler les ravageurs agricoles et porteurs de maladies.[3] Pour certains ravageurs agricoles, les phéromones sexuelles fabriquées sont placées dans des pièges pour capturer les adultes avant qu'ils ne puissent pondre (pondre leurs œufs) conduisant à l'éclosion de leurs larves destructrices.[3] Bien qu'il existe des milliers de produits chimiques que les insectes peuvent détecter, il existe une gamme limitée que les insectes utilisent comme signaux pour se rapprocher ou s'éloigner de la source de l'odorant[6].
L'art de trouver un attractif ou un répulsif pour un insecte particulier d'intérêt est compliqué et un processus long et intensif. Par exemple, l'utilisation de phéromones n'attire les insectes qu'au stade de la reproduction, une courte période de leur vie[2]. Alors que les odeurs de nourriture peuvent être attrayantes pour les insectes affamés, elles ne seraient pas efficaces dans un champ plein d'une culture qui est agréable au goût pour cet insecte[2].
Attractants / répulsifs dépendant de la situation[modifier | modifier le code]
Les insectes utilisent le même signal pour de nombreuses utilisations différentes selon la situation, c'est ce qu'on appelle la parcimonie chimique[6]. Les situations qui peuvent changer la façon dont un insecte se comporte en réaction à une odeur sont des choses comme la concentration du composé, le stade de vie de l'insecte, son état d'accouplement, d'autres signaux olfactifs, l'état d'alimentation des insectes (affamé ou plein), le moment de jour, ou même la position du corps des insectes.[2],[3],[6] Par exemple, la drosophile est très attirée par le vinaigre de cidre de pomme, mais à des concentrations très élevées, un récepteur olfactif supplémentaire (qui a une faible affinité pour le vinaigre, Or85a) est activé, ce qui modifie le comportement de la mouche de l'attraction à l'aversion[3]. Ces différents comportements au même signal s'appellent la plasticité comportementale[2].
Gaz carbonique[modifier | modifier le code]
De nombreux insectes sont capables de détecter des changements infimes dans la concentration de CO 2[6] . Alors que le CO 2 s'est avéré être un attractif chez tous les arthropodes étudiés[6] et qu'il est très important dans la surveillance et le contrôle des moustiques, même cette réaction stéréotypée peut être plastique. Les drosophiles évitent le CO 2 lorsqu'elles marchent mais se dirigent vers lui lorsqu'elles volent[3].
DEET[modifier | modifier le code]
Il a été démontré que de nombreux insectes (et autres arthropodes) évitent les zones contenant du N,N-diéthyl-3-méthylbenzamide ou du DEET . Ils évitent naturellement le DEET, probablement parce qu'il s'agit d'un « confus » qui stimule les récepteurs gustatifs, ionotropes et olfactifs et « déforme » l'interaction d'autres odorants avec ces récepteurs.[3]
Voir également[modifier | modifier le code]
- Electroantennographie, Electro-olfactographie
- Machine olfaction, E-nez
- Bill S. Hansson
Notes et références[modifier | modifier le code]
- Carraher, Dalziel, Jordan et Christie, « Towards an understanding of the structural basis for insect olfaction by odorant receptors », Insect Biochemistry and Molecular Biology, vol. 66, , p. 31–41 (PMID 26416146, DOI 10.1016/j.ibmb.2015.09.010)
- Gadenne, Barrozo et Anton, « Plasticity in Insect Olfaction: To Smell or Not to Smell? », Annual Review of Entomology, vol. 61, , p. 317–333 (PMID 26982441, DOI 10.1146/annurev-ento-010715-023523, hdl 11336/19586)
- Li et Liberles, « Aversion and Attraction through Olfaction », Current Biology, vol. 25, no 3, , R120–R1209 (PMID 25649823, PMCID 4317791, DOI 10.1016/j.cub.2014.11.044)
- Yadav et Borges, « The insect ovipositor as a volatile sensor within a closed microcosm », Journal of Experimental Biology, vol. 220, no 9, , p. 1554–1557 (PMID 28468812, DOI 10.1242/jeb.152777)
- Carraher, Dalziel, Jordan et Christie, « Towards an understanding of the structural basis for insect olfaction by odorant receptors », Insect Biochemistry and Molecular Biology, vol. 66, , p. 31–41 (PMID 26416146, DOI 10.1016/j.ibmb.2015.09.010)
- Syed, « Chemical ecology and olfaction in arthropod vectors of diseases », Current Opinion in Insect Science, vol. 10, , p. 83–89 (PMID 29588018, DOI 10.1016/j.cois.2015.04.011)
- Gu, « Molecular Characterization and Differential Expression of Olfactory Genes in the Antennae of the Black Cutworm Moth Agrotis ipsilon », PLOS ONE, vol. 9, no 8, , e103420 (PMID 25083706, PMCID 4118888, DOI 10.1371/journal.pone.0103420, Bibcode 2014PLoSO...9j3420G)
- Gadenne, Barrozo et Anton, « Plasticity in Insect Olfaction: To Smell or Not to Smell? », Annual Review of Entomology, Annual Reviews, vol. 61, no 1, , p. 317–333 (ISSN 0066-4170, PMID 26982441, DOI 10.1146/annurev-ento-010715-023523, hdl 11336/19586, S2CID 207568844)
- Wilson, « Early olfactory processing in Drosophila: mechanisms and principles », Annual Review of Neuroscience, vol. 36, , p. 217–241 (PMID 23841839, PMCID 3933953, DOI 10.1146/annurev-neuro-062111-150533)
- Riabinina, Task, Marr et Lin, « Organization of olfactory centres in the malaria mosquito Anopheles gambiae », Nature Communications, vol. 7, , p. 13010 (PMID 27694947, PMCID 5063964, DOI 10.1038/ncomms13010, Bibcode 2016NatCo...713010R)
[[]]
