Umpolung
En chimie organique, l'umpolung (/umpoluŋ/ de l'allemand, renversement de polarité) est une modification chimique qui a pour but d'inverser la polarité d'un groupe fonctionnel[1],[2]. Cette modification permet l'application de réactions secondaires qui n'auraient pas été possibles autrement[3]. Ce concept a été introduit par Seebach et Corey. Des applications classiques de l'umpolung peuvent être trouvées dans l'utilisation des réactifs de Grignard ou la condensation benzoïnique.
Application aux carbonyles
[modifier | modifier le code]Un exemple classique d'inversion de polarité est l'utilisation de dithianes.
L'atome d'oxygène d'un groupement carbonyle est ordinairement plus électronégatif que l'atome de carbone. Cette différence fait que le carbonyle réagit comme un électrophile. Cette polarité peut être inversée lorsque le carbonyle est transformé en dithiane ou en thioacétal. Le groupement acyle est alors dit 'masqué'.
Lorsque le dithiane est formé à partir d'un aldéhyde comme l'acétaldéhyde, le proton acide peut être arraché par du n-butyllithium dans le THF à basse température. Le 2-lithio-1,3-dithiane ainsi généré peut réagir comme un nucléophile sur des halogénures d'alkyle comme le bromure de benzyle, avec d'autres carbonyles comme la cyclohexanone ou des oxiranes comme l'oxyde de styrène (voir ci-dessous). Après hydrolyse du dithiane, les produits finaux de réaction sont des α-alkylecétones ou des α-hydroxycétones.

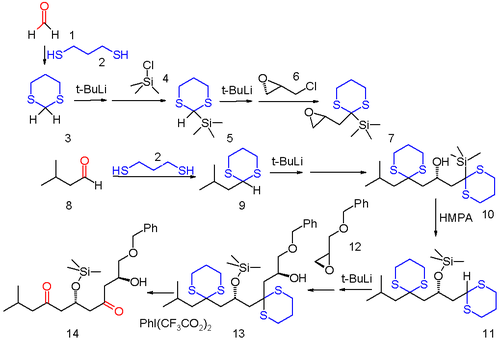
Ce type de séquence ouvre de nouvelles voies pour des transformations chimiques supplémentaires. Un exemple est la migration de charge négative (anion relay chemistry, en anglais) dans laquelle un groupement anionique résultant d'une réaction chimique est transféré à un autre endroit du même squelette carboné et reste disponible pour la réaction suivante[4]. Dans cet exemple de synthèse, le formaldéhyde (1) et le 3-méthylbutanal (8) sont tous deux transformés en les dithianes 3 et 9 avec le 1,3-propanedithiol. Le sulfide 3 est premièrement silylé par une réaction avec le tert-butyllithium et le chlorure de triméthylsilyle 4. Le proton restant est lui aussi arraché par tBuLi et l'anion résultant mis en présence de la (-)-épichlorohydrine 6. Le composé 7 obtenu est utilisé comme substrat avec l'autre dithiane 9 pour mener au produit d'ouverture de l'époxyde 10. Sous l'influence de l'HMPA, 10 subit un réarrangement de Brook pour donner l'éther silylé 11 qui comporte un motif dithiane équivalent à celui de 9. Ce dithiane réagit avec l'oxirane 12 pour former l'alcool 13. Dans l'étape finale les groupements sulfure sont enlevés avec le [bis(trifluoroacétoxy)iodo]benzène pour reformer les carbonyles.
Application aux énones
[modifier | modifier le code]Dans les additions nucléophiles des substrats conjugués classiques, le carbone en β agit comme un électrophile. Dans certains cas, cette position peut être modifiée pour réagir comme un nucléophile[5]. La réaction décrite dans le schéma 3 est un équivalent d'une réaction de Heck. Le catalyseur n'est pas le palladium, mais un carbène stable dérivé du triazole.

Ce carbène réagit avec l'ester α, β insaturé 1 sur la position β pour former l'énolate intermédiaire 2. Par tautomérisation, 2b devient 3 par migration de l'atome de brome. Une réaction d'élimination régénère le carbène et libère le produit 4.
Pour comparaison, dans la réaction de Baylis-Hillman, le même carbone électrophile en β est attaqué par un réactif et résulte en l'activation de la position α de l'énone.
Application aux amines
[modifier | modifier le code]L'atome d'azote d'un groupement amine agit habituellement comme un nucléophile par le biais de sa paire d'électrons libre. Cette polarité peut être inversée lorsqu'une amine primaire ou secondaire est substituée par un bon groupe partant, comme un halogène ou un groupement alkoxy. Le groupement N-substitué peut alors se comporter comme un électrophile sur l'atome d'azote et réagir comme un nucléophile, par exemple dans l'amination des carbanions.
Liens externes
[modifier | modifier le code]- (en) « umpolung », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
Voir aussi
[modifier | modifier le code]Références
[modifier | modifier le code]- (en) Seebach D., « Methods of Reactivity Umpolung », Angewandte Chemie International Edition in English, vol. 18, no 4, , p. 239–258 (DOI 10.1002/anie.197902393)
- (en) Gröbel B. T., Seebach D., « Reactivity of Carbonyl-Compounds Through Sulfur-Containing Reagents », Synthesis-Stuttgart, vol. 6, , p. 357–402 (DOI 10.1055/s-1977-24412)
- (en) Seebach D., Corey E. J., « Generation and synthetic applications of 2-lithio-1,3-dithianes », Journal of Organic Chemistry, vol. 40, no 2, , p. 231–237 (DOI 10.1021/jo00890a018, lire en ligne)
- (en) Smith A. B., III, Xian M., « Anion Relay Chemistry: An Effective Tactic for Diversity Oriented Synthesis », Journal of the American Chemical Society, vol. 128, no 1, , p. 66–67 (PMID 16390124, DOI 10.1021/ja057059w, lire en ligne)
- (en) Fischer C., Smith S. W., Powell D. A., Fu G. C., « Umpolung of Michael Acceptors Catalyzed by N-Heterocyclic Carbenes », Journal of the American Chemical Society, vol. 128, no 5, , p. 1472–1473 (PMID 16448117, PMCID 2553003, DOI 10.1021/ja058222q)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Umpolung » (voir la liste des auteurs).
