Synthèse monotope
En chimie, une synthèse monotope ou synthèse one-pot[1] est une synthèse chimique dans laquelle un réactif subit plusieurs réactions successives et/ou simultanées dans un seul mélange réactionnel (un seul réacteur, par exemple), donc en évitant les longs processus de séparation et de purification des composés intermédiaires. Ce type de réaction est activement recherché par les chimistes car il leur permet de gagner du temps et d'augmenter le rendement chimique global. Le processus par lequel une synthèse à multiples étapes est réduite à une synthèse monotope est appelé télescopage.
Un exemple d'une synthèse one-pot est la synthèse totale de la tropinone ou la synthèse de Gassman d'indoles.
Une synthèse monotope séquentielle est une synthèse pour laquelle les réactifs sont ajoutés au fur et à mesure, un à la fois, sans séparation intermédiaire.
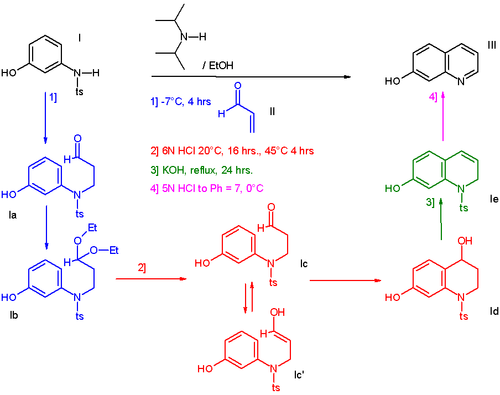
Dans une synthèse de ce type[2], la réaction du 3-N-tosylaminophénol I avec l'acroléine II produit l'hydroxy-quinoline III via 4 étapes séquentielles sans séparation des produits intermédiaires[3].
“One-pot” ou "Monotope” ?[modifier | modifier le code]
99 % des chimistes ne savent pas ce que signifie monotope parce que les scientifiques ne lisent pratiquement que des articles en anglais. Si l'Académie Française ou l'Académie des Sciences souhaitent franciser des termes anglais difficiles à traduire, ces nouveaux termes sont loin de faire l'unanimité.
On peut trouver sur internet des titres d'articles ou de thèses comportant le terme “monotope” mais cela reste très rare. Le choix de "monotope" ou de “one-pot” (en italique et/ou avec des guillemets) appartient à chacun.
Références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « One-pot synthesis » (voir la liste des auteurs).
- En anglais littéral : une synthèse dans un seul récipient
- One-Pot Preparation of 7-Hydroxyquinoline, Mark Cameron, R. Scott Hoerrner, James M. McNamara, Margaret Figus, and Scott Thomas; Org. Process Res. Dev., 2006, 10(1), pp. 149-152. {{DOI:dx.doi.org/10.1021/op0501545}}.
- L'addition de l'acroléine (en bleu) est une réaction de Michael catalysée par la N,N-diisopropylamine. La présence d'éthanol permet la conversion de l'aldéhyde en acétal (1b) mais cette réaction est inversée quand de l'acide chlorhydrique est ajouté au milieu réactionnel (en rouge). L'énolate réagit comme un électrophile dans une réaction de Friedel-Crafts avec fermeture de cycle. Le groupe alcool est éliminé en présence d'hydroxyde de potassium via une déshydratation (en vert) et quand dans l'étape finale, le milieu est neutralisé à pH 7 (en rose), le groupe tosyl est aussi éliminé.

