Réponse hypersensible

En pathologie végétale, la réponse hypersensible (RH), est le mécanisme spécifique de réaction des plantes à l'attaque par un agent pathogène. Destinée à prévenir la propagation d'une infection locale, la réponse hypersensible se caractérise par la mort rapide de cellules voisines du point d'infection, par nécrose (réponse se caractérisant par des lésions ou taches nécrotiques) ou apoptose (lésions apoptotiques). Son rôle est de limiter la croissance et la propagation des agents pathogènes dans le reste de la plante. Ce mécanisme rappelle le système immunitaire inné chez les animaux et précède généralement une réponse systémique (généralisée à la plante entière) plus lente à se mettre en place, qui conduit finalement à la résistance systémique acquise (RSA)[1].
Mécanisme
[modifier | modifier le code]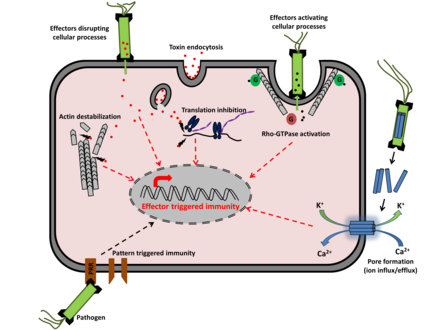
La réponse hypersensible est déclenchée par la plante quand elle reconnaît un agent pathogène. L'identification d'un agent pathogène se produit généralement lorsque les produits d'un gène d'avirulence, sécrétés par un agent pathogène, se lient aux produits d'un gène (R) de résistance de la plante (relation gène pour gène), ou interagissent indirectement avec lui (l'interaction du pathogène avirulent avec la plante est incompatible puisque celui‐ci ne parvient pas à se développer dans les tissus autour de la lésion). Les gènes R sont très polymorphes, et de nombreuses plantes produisent différents types de produits de gène R, ce qui leur permet de reconnaître les produits de virulence sécrétés par de nombreux agents pathogènes différents[5].
Il est possible que les gènes d'avirulence codent des enzymes impliquées dans la production de molécules « signal », les éliciteurs, et que les gènes de résistance codent des récepteurs membranaires qui reconnaissent les éliciteurs[6].
Dans la première phase de la réponse hypersensible, l'activation des gènes R déclenche un flux d'ions, impliquant un efflux d'hydroxyde et potassium hors des cellules, et un afflux de calcium et d'Ion hydrogène dans les cellules[7].
Dans la deuxième phase, les cellules impliquées dans la réponse hypersensible génèrent une flambée oxydative en produisant dérivés réactifs de l'oxygène (DRO), anions superoxydes, péroxyde d'hydrogène, radicaux hydroxyles et oxyde nitreux. Ces composés affectent les fonctions de la membrane cellulaire, en partie par induction d'une péroxydation des lipides et en causant des dégâts aux lipides[7].
La modification des composants d'ions dans la cellule et la dégradation des composants cellulaires en présence des DRO entraînent la mort des cellules affectées et la formation de lésions locales. Les dérivés réactifs de l'oxygène déclenchent également le dépôt de lignine et de callose, ainsi que la réticulation des glycoprotéines riches en hydroxyproline préformées telles que le P33 à la matrice de la paroi via la tyrosine dans le motif PPPPY[7].
Ces composés servent à renforcer les parois des cellules entourant l'infection, ce qui crée une barrière et inhibe la propagation de l'infection[8].
Médiateurs
[modifier | modifier le code]On a montré que plusieurs enzymes sont impliquées dans la production des DRO. Par exemple, l'amine oxydase à cuivre catalyse la désamination oxydante des polyamines, en particulier de la putrescine, et libère les médiateurs DRO, péroxyde d'hydrogène et ammoniac[9]. Parmi les autres enzymes susceptibles de jouer un rôle dans la production des DRO figurent la xanthine oxydase, la NADPH oxydase, l'oxalate oxydase, la péroxydases et les flavines contenant des amine oxydases[7].
Dans certains cas, les cellules entourant la lésion synthétisent des composés antimicrobiens, notamment des composés phénoliques, des phytoalexines et des protéines connexes (PR) de la pathogenèse, y compris des ß-glucanases et des chitinases. Ces composés peuvent agir en perforant les parois cellulaires bactériennes ou fongiques, ou en retardant la maturation, en perturbant le métabolisme, ou en prévenant la reproduction de l'agent pathogène en question.
Des études ont suggéré que le mode et la séquence réels du démantèlement des composants cellulaires des plantes dépendent des interactions spécifiques de chaque couple plante-pathogène, mais toutes les réponses hypersensibles semblent exiger l'implication de protéases à cystéine. L'induction de la mort cellulaire et l'élimination des agents pathogènes nécessitent également une synthèse active des protéines, un cytosquelette d'actine intact et la présence d 'acide salicylique[5].
Évasion des agents pathogènes
[modifier | modifier le code]Les agents pathogènes ont développé plusieurs stratégies visant à supprimer les réponses de défense des plantes. Les processus biologiques de l'hôte habituellement ciblés par des bactéries comprennent notamment des modifications des voies de la mort cellulaire programmée, en particulier l'inhibition des défenses basées sur les parois cellulaires et l'altération de la signalisation des hormones végétales et de l'expression des gènes de défense[10].
Notes et références
[modifier | modifier le code]- (en) Scott Freeman, Biological Science. : Plant Defense Systems, Prentice Hall, (lire en ligne), « Chapter 37 ».
- Patterns-triggered immunity ou immunité induite par les motifs, dont les PAMPs.
- Effector-triggered immunity ou immunité induite par les effecteurs (en).
- Luciano Paolozzi, Jean-Claude Liébart, Matthieu Arlat, Michel Dion, Harivony Rakotoarivonina, Introduction à la microbiologie. Microbiologie fondamentale et appliquée, Dunod, (lire en ligne), p. 183
- (en) MC. Heath, « Hypersensitive response-related death », Plant Molecular Biology, vol. 44, no 3, , p. 321–34 (DOI 10.1023/A:1026592509060).
- William G. Hopkins, Physiologie végétale, De Boeck Supérieur, , p. 467
- (en) Ben Matthews, « The Hypersensitive Response » [archive du ], The United States Department of Agriculture. (consulté le ).
- (en) D, Pontier, Balague C et Roby D., « The hypersensitive response. A programmed cell death associated with plant resistance », C R Acad Sci III, vol. 321, no 9, , p. 721–34 (DOI 10.1016/s0764-4469(98)80013-9).
- (en) T Koyanagi, Matsumura K, Kuroda S et Tanizawa K., « Molecular cloning and heterologous expression of pea seedling copper amine oxidase », Biosci Biotechnol Biochem., vol. 64, no 4, , p. 717–22 (DOI 10.1271/bbb.64.717).
- (en) RB Abramovitch et GB Martin, « Strategies used by bacterial pathogens to suppress plant defenses », Current Opinion in Plant Biology, vol. 7, no 4, , p. 356–64 (DOI 10.1016/j.pbi.2004.05.002).
