Liaison peptidique
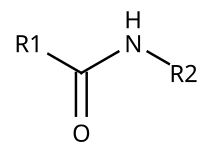
Une liaison peptidique est une liaison covalente qui s'établit entre la fonction carboxyle portée par le carbone α d'un acide aminé et la fonction amine portée par le carbone α de l'acide aminé suivant dans la chaîne peptidique. La liaison peptidique correspond à une fonction amide dans le cas particulier de certaines molécules biologiques. La liaison peptidique est une liaison plane et rigide[1].
Formation
[modifier | modifier le code]La liaison est le résultat de la réaction de condensation entre la fonction acide carboxylique COOH du premier acide aminé et la fonction amine NH2 du deuxième, avec comme produit secondaire une molécule d'eau H2O.
La liaison peptidique est fondamentale dans la formation des peptides, des polypeptides et des protéines. Après la constitution de la liaison peptidique, une extrémité est porteuse d'un groupe amine libre - l'extrémité N - ou amino-terminale, et l'autre d'un groupe carboxyl - extrémité C - ou carboxyl-terminale.

Propriétés
[modifier | modifier le code]Configurations et stabilité
[modifier | modifier le code]
Dans la liaison peptidique, le doublet non liant de l'atome d'azote a tendance à se délocaliser, formant une liaison double partielle entre l'azote et le carbone. Dit autrement, la liaison peptidique est stabilisée par mésomérie, dont les deux formes limites sont représentées ci-contre. Cela rend le groupe amide planaire, et rend difficile la rotation autour de l'axe azote-carbone. La liaison peptidique existe donc sous deux configurations : cis et trans.
Cette propriété est très importante dans l'établissement de la conformation tridimensionnelle des chaînes polypeptidiques. Si, en général, l'isomérisation entre les deux formes s'effectue librement dans les amides, les liaisons peptidiques des polypeptides repliés adoptent une conformation privilégiée. En effet, dans la forme cis, les chaînes latérales et les atomes de carbone alpha de résidus adjacents se gênent mutuellement. Du fait de cet encombrement stérique, le rapport cis/trans est de l'ordre 1:1000. Autrement dit, les groupements R des deux acides aminés sont en général alternés de part et d'autre de la liaison peptidique. Une exception notable de cette règle est la proline, pour laquelle la forme atypique du groupe latéral rend la configuration cis plus accessible[2].
Longueurs et angles
[modifier | modifier le code]
La longueur d'une liaison peptidique est de 1,33 Å = 133 pm (= 1,33 × 10−10 m).
Elle est donc plus courte qu'une liaison simple ordinaire mais plus longue qu'une liaison double.
De plus, la liaison peptidique est polaire, en raison de l'électronégativité de l'oxygène et de la charge + portée par l'azote.
Rupture
[modifier | modifier le code]Les liaisons peptidiques peuvent être cassées par protéolyse grâce à des enzymes appelées peptidases.
Références
[modifier | modifier le code]- (en) Pauling, Linus, 1901-1994., The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry, Ithaca/New York, Cornell University Press, , 644 p. (ISBN 0-8014-0333-2, OCLC 545520, lire en ligne)
- L'Actualité chimique, juillet 2002, p. 12.
