Benzylamine
| Benzylamine | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | phénylméthanamine[1] | ||
| Synonymes |
α-aminotoluène, 1-phénylméthanamine |
||
| No CAS | |||
| No ECHA | 100.002.595 | ||
| No CE | 202-854-1 | ||
| No RTECS | DP1488500 | ||
| DrugBank | DB02464 | ||
| PubChem | 7504 | ||
| ChEBI | 40538 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à jaune à odeur d'ammoniac[1],[2] | ||
| Propriétés chimiques | |||
| Formule | C7H9N [Isomères] |
||
| Masse molaire[3] | 107,153 1 ± 0,006 4 g/mol C 78,46 %, H 8,47 %, N 13,07 %, |
||
| pKa | 9,33 à 25 °C[1] 11,6 dans l'eau (cc = 100 g/l)[1] |
||
| Propriétés physiques | |||
| T° fusion | 10 °C[1],[2],[4] | ||
| T° ébullition | 185 °C[1],[2],[4] | ||
| Solubilité | miscible à l'eau, l'éthanol et l'éther diéthylique, très soluble dans l'acétone, peu dans le chloroforme[1] | ||
| Masse volumique | 0,98 g·cm-3[2] | ||
| T° d'auto-inflammation | 405 °C[1] 390 °C[2] |
||
| Point d’éclair | 65 °C[1],[2],[4] | ||
| Limites d’explosivité dans l’air | 0,7 vol. % - 8,2 vol. %[2] | ||
| Pression de vapeur saturante | 0,6 mbar à 20 °C[2] 1,3 mbar à 30 °C[2] 5,2 mbar à 50 °C[2] |
||
| Viscosité dynamique | 1,78 mPa-s à 21,2 °C[1] 0.295 mPa-s à 178,2 °C[1] |
||
| Cristallographie | |||
| Système cristallin | tétragonal | ||
| Classe cristalline ou groupe d’espace | P43[5] | ||
| Paramètres de maille | a 10.623(3)Å, b 10.623(3)Å, c 5.5031(18)Å, α 90°, β 90°, γ 90°[5] | ||
| Propriétés optiques | |||
| Indice de réfraction | = 1,543[4] | ||
| Précautions | |||
| SGH[4],[2] | |||
| H314, H302+H312, P280, P310 et P305+P351+P338 |
|||
| Transport[4] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 600 mg/kg (souris, i.p.)[6] | ||
| LogP | (octanol/eau) 1,09[6] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
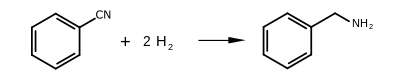
La benzylamine est un composé chimique de formule C6H5CH2NH2. Il consiste en un groupe benzyle, C6H5CH2, lié à un groupe fonctionnel amine. Ce liquide incolore est un précurseur de réaction répandu en synthèse organique.
Production[modifier | modifier le code]
La benzylamine peut être produit par un grand nombre de méthodes. Le procédé le plus répandu dans le milieu industriel est la réaction du chlorure de benzyle avec de l'ammoniac. Elle est également produite par la réduction du benzonitrile, ou l'amination réductrice du benzaldéhyde sur du nickel de Raney[7].
Utilisations[modifier | modifier le code]
Elle est utilisée comme source masquée d'ammoniaque, puisque le groupe benzène peut être supprimé par hydrogénolyse[8]:
- C6H5CH2NH2 + 2 RBr → C6H5CH2NR2 + 2 HBr
- C6H5CH2NR2 + H2 → C6H5CH3 +R2NH
Assez souvent, une base est utilisée lors de la première étape pour neutraliser le HBr (ou l'acide correspond si l'halogène présent est différent du brome).
Références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « benzylamine » (voir la liste des auteurs).
- PubChem CID 7504
- Entrée « Benzylamine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26/08/2015 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Benzylamine 99%, consultée le 26/08/2015.
- Structure summary on Cambridge Cristallographic Data Center.
- (en) « Benzylamine », sur ChemIDplus.
- Lutz Heuer, « Benzylamines », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a04_009.pub2)
- Gatto, V. J.; Miller, S. R.; Gokel, G. W., 4,13-Diaza-18-Crown-6, Org. Synth., coll. « vol. 8 », , p. 152 (example of alklylation of benzylamine followed by hydrogenolysis).