Acétylcholinestérase
| Acétylcholinestérase | ||
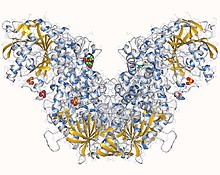
 Structure d'une acétylcholinestérase humaine (PDB 1B41[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | ACHE | |
| N° EC | 3.1.1.7 | |
| Homo sapiens | ||
| Locus | 7q22.1 | |
| Masse moléculaire | 67 796 Da[2] | |
| Nombre de résidus | 614 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
En enzymologie, une acétylcholinestérase est une hydrolase qui catalyse la réaction :
Ces enzymes assurent le clivage de l'acétylcholine, un neurotransmetteur, en ion acétate et choline dans les synapses, réaction nécessaire pour permettre aux neurones cholinergiques de revenir à l'état de repos après leur activation par des influx nerveux, par exemple dans les plaques motrices.
On trouve également une protéine de 535 résidus d'acides aminés, N-glycosylée, ayant une activité enzymatique d'acétylcholinestérase (AChE) liée par un glycosylphosphatidylinositol (GPI) à la surface des globules rouges. Le polymorphisme (Yta→Ytb : His353Asn) de cette AChE érythrocytaire est à l'origine des antigènes du système de groupes sanguins Cartwright, système YT (011) antigènes Yta (001) très fréquent et Ytb(002) rare. Gène ACHE, OMIM (en) 112100, localisé en 7q22.1, fréquences allèliques en Europe : Yta 0.9559, Ytb 0.0441. Lié génétiquement au gène Kell, lod score de 3.48 pour Θ = 0.28, soit une distance de 28 centimorgans. Un épissage au niveau du quatrième exon fait qu'au niveau C-terminal cette protéine peut être ancrée par un GPI à la surface de l'érythrocyte, mais pas sur le tissu nerveux[3].
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Notes et références[modifier | modifier le code]
- (en) G. Kryger, M. Harel, K. Giles, L. Toker, B. Velan, A. Lazar, C. Kronman, D. Barak, N. Ariel, A. Shafferman, I. Silman et J. L. Sussman, « Structures of recombinant native and E202Q mutant human acetylcholinesterase complexed with the snake-venom toxin fasciculin-II », Acta Crystallographica. Section D, Biological Crystallography, vol. 56, no Pt 11, , p. 1385-1394 (PMID 11053835, DOI 10.1107/S0907444900010659, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Geoff Daniels, Human Blood Groups, 2e édition, Blackwell Publishing.
- (en) Yves Bourne, Palmer Taylor, Pierre E. Bougis et Pascale Marchot, « Crystal Structure of Mouse Acetylcholinesterase – A Peripheral Site-Occluding Loop in a Tetrameric Assembly », Journal of Biological Chemistry, vol. 274, no 5, , p. 2963-2970 (PMID 9915834, DOI 10.1074/jbc.274.5.2963, lire en ligne)
- (en) Florian Nachon, Oluwatoyin A. Asojo, Gloria E. O. Borgstahl, Patrick Masson et Oksana Lockridge, « Role of Water in Aging of Human Butyrylcholinesterase Inhibited by Echothiophate: The Crystal Structure Suggests Two Alternative Mechanisms of Aging », Biochemistry, vol. 44, no 4, , p. 1154-1162 (PMID 15667209, DOI 10.1021/bi048238d, lire en ligne)