Hypoglycine A
| Hypoglycine A | |

| |
| Identification | |
|---|---|
| Nom UICPA | acide (S)-2-amino-3-((R)-2-méthylènecyclopropyl)propanoïque |
| Synonymes |
hypoglycine A; hypoglycine ; 2-méthylènecyclopropanylalanine |
| No CAS | |
| No ECHA | 100.189.936 |
| PubChem | 11768666 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C7H11NO2 [Isomères] |
| Masse molaire[1] | 141,167 7 ± 0,007 2 g/mol C 59,56 %, H 7,85 %, N 9,92 %, O 22,67 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'hypoglycine A (parfois aussi simplement appelée hypoglycine) est l'une des deux hypoglycines, des phytotoxines présentes notamment dans les fruits d'akée (Blighia sapida), responsable de graves intoxications alimentaires caractérisées par des vomissements et des hypoglycémies, connues sous le nom de maladie des vomissements de la Jamaïque[2]. Ces toxines tiennent leur nom de leur forte activité hypoglycémiante. On retrouve également cette substance dans les samares des érables sycomores, qui sont alors à l'origine de la myopathie atypique des équidés.
Structure
[modifier | modifier le code]L'hypoglycine A a une structure dérivée de l'alanine. Il s'agit de la 2-méthylènecyclopropanylalanine.
Synthèse
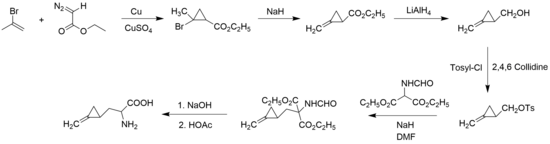
[modifier | modifier le code]En 1958, John Carbon, William Martin et Leo Swett sont les premiers à synthétiser l'hypoglycine A, sous forme de racémique, à partir du 2-bromopropène et du diazoacétate d'éthyle, pour former le cycle de cyclopropane[3] :
Toxicité
[modifier | modifier le code]La toxicité de l'hypoglycine A vient de ses métabolites, notamment l'acide méthylènecyclopropylacétique et les esters de méthylènecyclopropaneacétyle avec la carnitine et la coenzyme A. Ces deux derniers composés sont des cofacteurs nécessaires à l'oxydation des acides gras. De plus, la MCPA-CoA bloque une partie des enzymes acyl-CoA déshydrogénase requises pour la néoglucogenèse[4].
Cette obstruction dans la néoglucogenèse et l'oxydation des acides gras est soupçonnée d'être à l'origine de la plupart des symptômes de la maladie des vomissements de la Jamaïque. Ce blocage du métabolisme des acides gras oblige les cellules à utiliser le glycogène comme source d'énergie. Une fois le glycogène épuisé, le corps est incapable d'en produire plus, ce qui provoque de sévères crises d'hypoglycémie. On détecte ces effets biochimiques via un excès d'acides gras de milieu de chaîne dans les urines et une acidose.
On traite cette intoxication en contrant ces changements biochimiques, notamment par injection intraveineuse de glucose, voire par hémodialyse en cas d'insuffisance rénale[5].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Ackee Fruit Toxicity », Medscape
- Carbon, J. A.;Martin, W. B.;Swett, L. R., « SYNTHESIS OF α-AMINO- METHYLENECYCLOPROPANEPROPIONIC ACID (HYPOGLYCIN A) », J. Am. Chem. Soc., vol. 80, , p. 1002-1002 (DOI 10.1021/ja01537a066)
- (en) « THE ACKEE FRUIT (BLIGHIA SAPIDA) AND ITS ASSOCIATED TOXIC EFFECTS », University of British Columbia
- (en) « Hypoglycin », TOXNET
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hypoglycin A » (voir la liste des auteurs).
