2-Aminobenzaldéhyde
| 2-Aminobenzaldéhyde | |

| |
| Identification | |
|---|---|
| Nom systématique | 2-aminobenzaldéhyde |
| Synonymes |
ortho-aminobenzaldéhyde |
| No CAS | |
| No ECHA | 100.007.687 |
| No CE | 208-454-3 |
| PubChem | 68255 |
| SMILES | |
| InChI | |
| Apparence | solide cristallin jaune clair[1] |
| Propriétés chimiques | |
| Formule | C7H7NO [Isomères] |
| Masse molaire[2] | 121,136 6 ± 0,006 6 g/mol C 69,41 %, H 5,82 %, N 11,56 %, O 13,21 %, |
| Propriétés physiques | |
| T° fusion | 37 °C[1] |
| T° ébullition | 80 à 85 °C (3 hPa)[1] |
| Point d’éclair | 113 °C (coupelle fermée)[1] |
| Précautions | |
| SGH[1] | |
| H315, H319, H335, P280, P362, P304+P340+P312, P305+P351+P338, P332+P313, P337+P313 et P403+P233 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le 2-aminobenzaldéhyde ou ortho-aminobenzaldéhyde est un composé aromatique de formule C6H4(NH2)CHO. Constitué d'un cycle de benzène substitué par un groupe aldéhyde et un groupe amine en position 1,2, c'est l'un des trois isomères de l'aminobenzaldéhyde, le composé ortho.
Propriétés
[modifier | modifier le code]Le 2-aminobenzaldéhyde se présente sous la forme d'un solide cristallin jaune pâle. Il est relativement instable et tend à se condenser avec lui-même ; pour cette raison, il est conseillé de le stocker à basse température (−20 °C)[1].
Synthèse
[modifier | modifier le code]Le 2-aminobenzaldéhyde est généralement préparé par réduction du 2-nitrobenzaldéhyde par le fer[3] ou le sulfate de fer(II)[4].
Utilisations
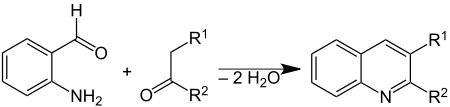
[modifier | modifier le code]Le 2-aminobenzaldéhyde est principalement utilisé pour la synthèse d'autres composés. Il est en particulier utilisé pour la synthèse des quinoléines, une famille de composés organiques dont certains sont utilisés comme antiviraux ou antipaludiques, mais également des composés organiques électroluminescents utilisés pour la production d'OLEDs et de cellules photovoltaïques. Une méthode de choix pour le faire est la synthèse de Friedlaender, où il est condensé avec un composé carbonylé[5] :
Par des réactions de modèle (en), il forme des produits de condensation trimériques et tétramériques qui ont été étudiés comme ligands.

Structure d'un complexe nickel-eau-nitrate avec un ligand dérivé d'un produit de condensation de trois équivalents de 2-aminobenzaldéhyde[6].
Le 2-aminobenzaldéhyde est également utilisé dans la préparation d'indoles substitués[7].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 2-Aminobenzaldehyde » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé 2-Aminobenzaldehyde, consultée le 6 avril 2020.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Chen Zhang, Chandra Kanta De et Daniel Seidel, « o-Aminobenzaldehyde, Redox-Neutral Aminal Formation and Synthesis of Deoxyvasicinone », Org. Synth., vol. 89, , p. 274 (DOI 10.15227/orgsyn.089.0274)
- Lee Irvin Smith et J. W. Opie, « o-Aminobenzaldehyde », Org. Synth., vol. 28, , p. 11 (DOI 10.15227/orgsyn.028.0011)
- Friedländer, P., « Ueber o-Amidobenzaldehyd », Chemische Berichte, vol. 15, no 2, , p. 2572–2575 (DOI 10.1002/cber.188201502219, lire en ligne)
- Fleischer et Klem, « The Structure of a Self-Condensation Product of o-Aminobenzaldehyde in the Presence of Nickel Ions », Inorganic Chemistry, vol. 4, , p. 637-642 (DOI 10.1021/ic50027a008)
- Levesque, P., Fournier, P.-A., « Synthesis of Substituted Indole from 2-Aminobenzaldehyde through [1,2]-Aryl Shift », The Journal of Organic Chemistry, vol. 75(20), , p. 7033–7036 (DOI 10.1021/jo1016713)