Réaction d'expansion de cycle de Dowd-Beckwith
La réaction d'expansion de cycle de Dowd-Beckwith est une réaction organique dans laquelle un β-cétoester cyclique peut voir son cycle augmenté de un à quatre atomes de carbone par une réaction d'expansion de cyle radicalaire via un substituant α-alkylhalogéné[1],[2],[3], l'amorceur radicalaire étant un mélange d'AIBN et d'hydrure de tributylétain. Le β-cétoester cyclique peut être obtenu par condensation de Dieckmann.
La réaction originale consiste en une substitution nucléophile d'un énolate de cyclohexanone-2-carboxylate d'éthyle avec le 1,4-diiodobutane et l'hydrure de sodium, suivie par une expansion de cycle en cyclodécanone-6-carboxylate d'éthyle. Un sous-réaction est la réduction organique de l'iodoalcane.

Mécanisme réactionnel[modifier | modifier le code]
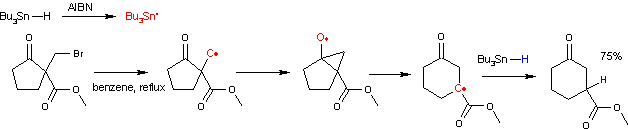
Le mécanisme réactionnel est présenté ci-dessus partir d'un dérivé de cyclopentanone. La réaction débute par la substitution nucléophile de l'atome d'hydrogène en α des groupes carbonyle et carboxyle par un groupe halogénoalkyle, ici un groupe bromométhyle (1). La réaction radicalaire est elle amorcée par la décomposition thermique de l'AIBN. La radical en résultant retire un hydrogène à l'hydrure de tributylétain, qui, à son tour, retire l'atome d'halogène du groupe halogénoalkyle pour former un radical alkyle (2). Ce radical attaque ensuite le groupe carbonyle formant un intermédiaire cétyle bicyclique (3). Cet intermédiaire se réarrange ensuite par une expansion de cycle en un nouveau radical carboné (4) qui se recombine enfin avec un proton radicalaire issu de l'hydrure de tributylétain, propageant ainsi le cycle catalytique.
Compléments[modifier | modifier le code]

Une étude[4] a montré que le succès de la réaction dépend de façon critique de l'accessibilité du groupe carbonyle. Des expériences avec des composés deutérés ont aussi montré qu'un déplacement d'hydrure 1,5 se produit. La réaction du radical alkyle avec l'un des atomes d'oxygène du groupe carboxyle est aussi possible, mais l'énergie d'activation est dans ce cas défavorable.
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dowd–Beckwith ring-expansion reaction » (voir la liste des auteurs).
- Paul Dowd, Soo Chang Choi, Free radical ring expansion by three and four carbons, J. Am. Chem. Soc., 1987, 109(21), 6548–6549, Résumé
- Paul Dowd, Soo Chang Choi, A new tributyltin hydride-based rearrangement of bromomethyl .beta.-keto esters. A synthetically useful ring expansion to .gamma.-keto esters, J. Am. Chem. Soc., 1987, 109(11), 3493–3494, Résumé
- Athelstan L. J. Beckwith, D. M. O'Shea, Steven W. Westwood, Rearrangement of suitably constituted aryl, alkyl, or vinyl radicals by acyl or cyano group migration, J. Am. Chem. Soc., 1988, 110(8), 2565–2575, Résumé
- Diego Ardura et Tomás L. Sordo, Three-Carbon Dowd–Beckwith Ring Expansion Reaction versus Intramolecular 1,5-Hydrogen Transfer Reaction: A Theoretical Study, J. Org. Chem., 2005, 70(23), p. 9417 – 9423 ; (Article) DOI 10.1021/jo051551g « Résumé »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
