Hexachloroiridate d'ammonium
| Hexachloroiridate d'ammonium | ||
| ||
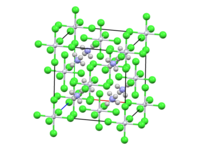 | ||
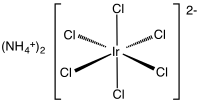
| Structure de l'hexachloroiridate d'ammonium. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Hexachloroiridate(IV) d'ammonium | |
| No CAS | ||
| No ECHA | 100.037.264 | |
| No CE | 241-007-0 | |
| PubChem | 16211476 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre maron foncé[1] | |
| Propriétés chimiques | ||
| Formule | (NH4)2IrCl6 | |
| Masse molaire[2] | 441,012 ± 0,016 g/mol H 1,83 %, Cl 48,23 %, Ir 43,59 %, N 6,35 %, |
|
| Propriétés physiques | ||
| T° fusion | décomposition vers 320 °C sous atmosphère d'azote ou dans l'air (à la pression atmosphérique)[3] | |
| Masse volumique | 2,86 g·cm-3 (25 °C)[1] | |
| Précautions | ||
| SGH[1] | ||
| H302+H312+H332 et P280 |
||
| NFPA 704[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'hexachloroiridate d'ammonium[3] est un composé inorganique de formule (NH4)2[IrCl6]. Ce sel d'ammonium du complexe d'iridium(IV) [IrCl6]2− se présente sous la forme solide brun foncé. C'est un composé commercialement important de l'iridium[4], l'un des complexes les plus communs d'iridium(IV). Un composé proche mais mal défini est le tétrachlorure d'iridium, les deux composés étant utilisés de manière interchangeable[5].
Structure[modifier | modifier le code]
Ce composé a été caractérisé par cristallographie aux rayons X ; il cristallise avec une structure cubique semblable à celle de l'hexachloroplatinate d'ammonium, les centres de [IrCl6]2− adoptant une géométrie moléculaire octaédrique[6].
Production[modifier | modifier le code]
L'hexachloroiridate d'ammonium est produit par réaction en solution aqueuse entre le chlorure d'ammonium et l'hexachloroiridate de sodium et récupéré par précipitation[3],[7].
Utilisations[modifier | modifier le code]
L'hexachloroiridate d'ammonium et un intermédiaire clé dans l'isolation de l'iridium à partir de minerais. La plupart des autres métaux forment des sulfures insolubles en solution aqueuse lorsque leurs chlorures sont traités par le sulfure d'hydrogène, mais [IrCl6]2− résiste à cette substitution de ligands. Chauffé sous atmosphère d'hydrogène, le sel se convertit en métal[4] :
- (NH4)2[IrCl6] + 2 H2 → Ir + 6 HCl + 2 NH3
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ammonium_hexachloroiridate(IV) » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Ammonium hexachloroiridate(IV), consultée le 16 juin 2019.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- G. Pannetier et R. Bonnaire, « L'hexachloroiridate d'ammonium étude de son spectre d'absorption infrarouge et des conditions de sa thermolyse », Elsevier BV, vol. 18, no 4, , p. 411–417 (ISSN 0022-5088, DOI 10.1016/0022-5088(69)90010-1).
- Renner, H., Schlamp, G., Kleinwächter, I., Drost, E., Lüschow, H. M., Tews, P., Panster, P., Diehl, M., Lang, J., Kreuzer, T., Knödler, A., Starz, K. A., Dermann, K., Rothaut, J. et Drieselman, R., Ullmann's Encyclopedia of Industrial Chemistry, Wiley, (DOI 10.1002/14356007.a21_075), « Platinum group metals and compounds »
- Thomas R. B. Mitchell, « Iridium(IV) Chloride », e-EROS Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.ri050)
- Bokii, G.B.; Ussikov, P.I. "Roentgenographische Untersuchung der Struktur des Ammonium-Chlor-Iridats (N H4)2IrCl6 Doklady Akademii Nauk SSSR 1940, vol. 26, p782-p784.
- (en) George B. Kauffman, Larry A. Teter, J. W. Hogarth et F. P. Dwyer, Inorganic Syntheses, Hoboken, NJ, USA, John Wiley & Sons, Inc., (ISBN 978-0-470-13239-5, ISSN 1934-4716, DOI 10.1002/9780470132395.ch59), « Ammonium Hexachloroiridate(IV) ».


