Cétène (molécule)
| Cétène (molécule) | ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | éthènone | |
| Synonymes |
carbométhène |
|
| No CAS | ||
| No ECHA | 100.006.671 | |
| No CE | 207-336-9 | |
| PubChem | 10038 | |
| ChEBI | 48003 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C2H2O [Isomères] |
|
| Masse molaire[2] | 42,036 7 ± 0,002 g/mol C 57,14 %, H 4,8 %, O 38,06 %, |
|
| Moment dipolaire | 1,422 15 D [1] | |
| Propriétés physiques | ||
| T° fusion | −150 °C [3] | |
| T° ébullition | −49 °C [3] | |
| Limites d’explosivité dans l’air | 5,5 - 18 Vol%[4]. | |
| Point critique | 65,0 bar, 106,85 °C [5] | |
| Thermochimie | ||
| ΔfH0gaz | −87,24 kJ·mol-1 [6] | |
| ΔvapH° | 20,4 kJ·mol-1 [6] | |
| Cp | 51,75 J·K-1·mol-1 (gaz,25 °C) [6]
|
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 9,617 ± 0,003 eV (gaz)[8] | |
| Précautions | ||
| SIMDUT[9] | ||
  D1A, F, |
||
| NFPA 704[10] | ||
| Écotoxicologie | ||
| DL50 | 1,3 g·kg-1 (rat, oral) [9] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le cétène est un gaz toxique de formule semi-développée H2C=C=O, instable dans les conditions normales de température et de pression. Son tautomère est l'éthynol.
Propriétés physico-chimiques
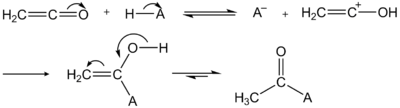
[modifier | modifier le code]Le cétène est un agent d'acétylation très puissant[3].
Utilisation
[modifier | modifier le code]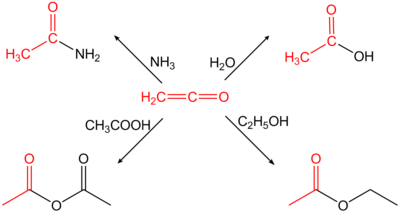
- Production de l'anhydride acétique
La majeure partie de la production du cétène est utilisée pour la production de l'anhydride acétique. Toutefois ce procédé est concurrencé par la carbonylation de l'acétate de méthyle[3].
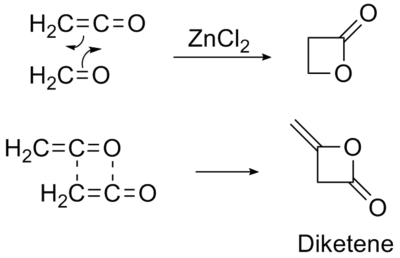
- Production du dicétène
La seconde utilisation du cétène est la production du dicétène par dimérisation contrôlée[3].
- Production de l'acide sorbique
La réaction du cétène avec le crotonaldéhyde produit le bêta-lactone ou du polyester. Ces derniers sont ensuite convertis par voie thermique ou par voie catalytique en acide sorbique[3].
Production et synthèse
[modifier | modifier le code]La principale voie de synthèse du cétène est la pyrolyse de l'acide acétique. Ce dernier est évaporé et chauffé à une température de 740 à 760 °C, puis du phosphate de triéthyle est ajouté comme catalyseur ainsi que de l'ammoniaque. L'ammoniaque empêche la recombinaison de l'eau et du cétène. Le mélange est ensuite refroidi à moins de 100 °C pour condenser l'eau et l'acide acétique n'ayant pas réagi, le cétène est alors absorbé dans un liquide de conditionnement ou récupéré sous forme de dicétène via une pompe à vide[3].

Notes et références
[modifier | modifier le code]- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Raimund Miller, Claudio Abaecherli, Adel Said et Barry Jackson, Ketenes, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry »,
- Entrée « Ketene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 25 novembre 2009 (JavaScript nécessaire)
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) « Ketene », sur NIST/WebBook, consulté le 25 novembre 2009
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Cétène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 novembre 2009
- UCB Université du Colorado





