Réaction de Sakurai
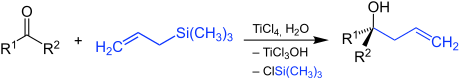
La réaction de Sakurai, ou réaction de Hosomi-Sakurai, est une réaction chimique entre un composé électrophile, tel qu'un composé carbonylé, et un silane allylique nucléophile, tel que l'allyltriméthylsilane CH2=CHCH2Si(CH3)3, pour former un alcool β-allylique substitué[1]. Elle est comparable à une réaction de Grignard mais n'a lieu qu'en présence d'acides de Lewis forts tels que le tétrachlorure de titane TiCl4, le trifluorure de bore BF3, le chlorure d'étain(II) SnCl2 ou le chlorure de diéthylaluminium (C2H5)2AlCl comme catalyseurs. Elle porte le nom des chimistes japonais Akira Hosomi (en) et Hideki Sakurai, qui l'ont publiée pour la première fois en 1976[1]. Comme pour les réaction de Grignard, le type de composé carbonylé utilisé détermine s'il se forme un alcool primaire, secondaire ou tertiaire, à partir respectivement du formaldéhyde (R1 = R2 = H), d'autres aldéhydes (R1 = alkyle, R2 = H) ou de cétones (R1 = alkyle et R2 = alkyle semblable ou différent) :
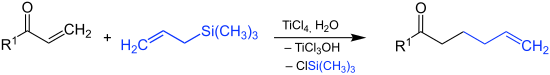
Il est également possible d'utiliser des imines, des acétals, des époxydes et des halogénures d'acyle[2]. Avec des cétones α,β-insaturées, il se produit par exemple une addition 1,4 :
Mécanisme
L'acide de Lewis active l'électrophile en augmentant sa charge positive partielle. Cela permet l'addition nucléophile du silane allylique, qui est l'étape limitant la vitesse de réaction[2] :

Le groupe triméthylsilyle –Si(CH3)3 ne se comporte pas comme un acide de Lewis. Pour cette raison, un état de transition cyclique peut être exclu. Dans les réactions de composés allyliques substitués avec des aldéhydes, il est possible que l'état de transition ait une conformation antipériplanaire[2] :

Notes et références
- (en) Akíra Hosomi et Hideki Sakurai, « Syntheses of γ,δ-unsaturated alcohols from allylsilanes and carbonyl compounds in the presence of titanium tetrachloride », Tetrahedron Letters, vol. 17, no 16, , p. 1295-1298 (DOI 10.1016/S0040-4039(00)78044-0, lire en ligne)
- (de) « Hosomi-Sakurai-Reaktion », sur https://www.organische-chemie.ch/ (consulté le ).
