Acide nitrobenzoïque
L'acide nitrobenzoïque est un composé aromatique de formule C7H5NO4. Il est constitué d'un cycle benzénique substitué par un groupe carboxyle (acide benzoïque) et un groupe nitro. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Propriétés
| Acide nitrobenzoïque | |||
| Nom | Acide 2-nitrobenzoïque | Acide 3-nitrobenzoïque | Acide 4-nitrobenzoïque |
| Autre nom | acide orthonitrobenzoïque acide o-nitrobenzoïque |
acide métanitrobenzoïque acide m-nitrobenzoïque |
acide paranitrobenzoïque acide p-nitrobenzoïque |
| Formule structurelle | 
|

|

|
| Numéro CAS | |||
| PubChem | (en) « Acide nitrobenzoïque », sur PubChem | (en) « Acide nitrobenzoïque », sur PubChem | (en) « Acide nitrobenzoïque », sur PubChem |
| Formule brute | C7H5NO4 | ||
| Masse molaire | 167,12 g·mol−1 | ||
| État | solide | ||
| Apparence | poudre blanche[1] | poudre cristalline jaunâtre faible odeur[2] |
poudre cristalline vert clair inodore[3] |
| Point de fusion | 146 à 148 °C[1] | 139 à 142 °C[2] | 239 à 242 °C[3] |
| Température de décomposition |
240 à 250 °C[1] | 240 à 250 °C[2] | >240 °C[3] |
| Masse volumique (20 °C) |
1,575 g·cm-3[1] | 1,49 g·cm-3[2] | 1,61 g·cm-3[3] |
| Point d'éclair | 190 °C (coupelle fermée)[2] | 237 °C (coupelle fermée)[3] | |
| PkA | 2,22[4] | 3,44[4] | 3,42[5] |
| LogP | 1,46[1] | 1,83[2] | 1,89[3] |
| Solubilité dans l'eau | 7,8 g·l-1 (25 °C)[1] | 3 g·l-1 (25 °C)[2] | 0,42 g·l-1 (20 °C)[3] |
| SGH[1],[2],[3] |
|||
| Phrase H et P[1],[2],[3] | H315, H319 et H335 |
H302, H315, H319, H335 et H412 |
H302 et H319 |
| P261 et P305+P351+P338 |
P262, P273 et P305+P351+P338 |
P301+P330+P331 P264, P280 et P337+P313 | |
Les acides nitrobenzoïques sont des solides cristallins respectivement blanc, jaunâtre et vert clair. Leurs points de fusion sont très différents, notamment celui de l'acide 4-nitrobenzoïque, qui présente la plus grande symétrie, bien plus élevé que le deux autres. Les acides nitrobenzoïques ont une acidité plus élevée que l'acide benzoïque en raison de l'effet -M du groupe nitro, ce qui augmente la stabilité de l'anion issu du départ d'un ion H+. Leurs pkA – respectivement 2,22, 3,44 et 3,42 – sont donc inférieurs à celui de l'acide benzoïque (4,20[4]).
Synthèse
L'acide 3-nitrobenzoïque est obtenu à partir du benzoate de méthyle par réaction avec de l'acide nitrique fumant en présence d'acide sulfurique concentré[6]. Après nitration, le 3-nitrobenzoate de méthyle résultant est saponifié pour donner l'acide correspondant[7].

Il est possible de nitrer directement l'acide benzoïque, le groupe carboxyle tant orienteur méta, mais il se forme généralement de l'acide 3,5-dinitrobenzoïque.
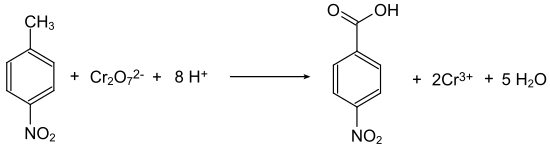
En général, les acides nitrobenzoïques sont accessibles à partir des nitrotoluènes équivalents, par oxydation du groupe méthyle. Ainsi, le 4-nitrotoluène est oxydé avec du dichromate de sodium en présence d'acide sulfurique concentré pour donner de l'acide 4-nitrobenzoïque[8]
Utilisations
Analytiques
L'acide 4-nitrobenzoïque est principalement utilisé dans l'analyse des substances organiques par dérivation. Les substances liquides ou à bas point de fusion sont transformées à cette fin en dérivés facilement cristallisables ; les alcools, par exemple, peuvent être identifiés en mesurant les points de fusion de leurs esters d'acide 4-nitrobenzoïque ou d'acide 3,5-dinitrobenzoïque. À cette fin, la substance à analyser est mise à réagir avec de l'acide 4-nitrobenzoïque en présence de petites quantités d'acide sulfurique.
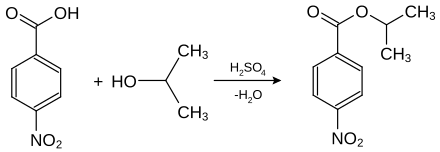
Détection de l'isopropanol comme dérivé de l'acide 4-nitrobenzoïque, le 4-nitrobenzoate de 2-propyle (point de fusion de 100,5 °C[4]).
Les points de fusion de ces dérivés sont généralement marqués, et connus avec précision. Cette réaction convient également pour de nombreuses amines. Les dérivés de l'acide 3,5-dinitrobenzoïque ont généralement des points de fusion plus élevés que ceux de l'acide 4-nitrobenzoïque[4] ; ils sont préférés lorsque le point de fusion de l'ester d'acide 4-nitrobenzoïque est trop bas et qu'aucune détermination précise n'est possible.
Si la substance à analyser est plus fragile, on utilise plutôt une réaction directe avec le chlorure d'acyle correspondant, le chlorure de 4-nitrobenzoyle. Il est également possible d'obtenir des dérivés d'acides aminés par cette méthode.
Synthèse
L'acide 3-aminobenzoïque peut être obtenu par réduction de l'acide 3-nitrobenzoïque. On utilise par exemple comme agent réducteur le zinc élémentaire dans l'acide chlorhydrique[9] ou l'hydrazine[10].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Nitrobenzoesäuren » (voir la liste des auteurs).
- Entrée « 2-Nitrobenzoic acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-02-03 (JavaScript nécessaire).
- Entrée du numéro CAS « 121-92-6 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-02-03 (JavaScript nécessaire).
- Entrée du numéro CAS « 62-23-7 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2021-02-03 (JavaScript nécessaire).
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6).
- (de) Beyer/Walter, Lehrbuch der Organischen Chemie, Stuttgart, S. Hirzel Verlag, , 19e éd. (ISBN 3-7776-0356-2), p. 511.
- Oliver Kamm, J. B. Segur, Methyl m-nitrobenzoate, Org. Synth. 3, coll. « vol. », , 71 p.
- Oliver Kamm, J. B. Segur, m-Nitrobenzoic acid, Org. Synth. 3, coll. « vol. », , 73 p.
- O. Kamm, A. O. Matthews, p-Nitrobenzoic acid, Org. Synth. 2, coll. « vol. », , 53 p.
- (de) J. Wilbrand, F. K. Beilstein, « Ueber eine neue Reihe isomerer Verbindungen der Benzoëgruppe. – Nitrodracylsäure und deren Derivate », J. Liebigs Ann. Chem., no 128, , p. 257–273 (DOI 10.1002/jlac.18631280302).
- T. Curtius, « Die Einwirkung von Hydrazinhydrat auf Nitroverbindungen. I. Abhandlung », J. Prakt. Chem., vol. 76, , p. 233–237 (DOI 10.1002/prac.19070760116).

