(Cyclopentadiényl)cobalt dicarbonyle
| (Cyclopentadiényl)cobalt dicarbonyle | |||
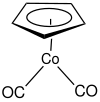
| |||
| Structure du (cyclopentadiényl)cobalt dicarbonyle | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | dicarbonyl(η5-2,4-cyclopentadién-1-yl)cobalt | ||
| Synonymes |
CpCo(CO)2 |
||
| No CAS | |||
| No ECHA | 100.031.933 | ||
| No CE | 235-139-8 | ||
| PubChem | 9942301 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide brun rougeâtre[1] | ||
| Propriétés chimiques | |||
| Formule | C7H5CoO2 |
||
| Masse molaire[2] | 180,046 6 ± 0,006 6 g/mol C 46,7 %, H 2,8 %, Co 32,73 %, O 17,77 %, |
||
| Propriétés physiques | |||
| T° fusion | −22 °C[1] | ||
| T° ébullition | 139 à 140 °C[1] | ||
| Point d’éclair | 26 °C[1] | ||
| Précautions | |||
| SGH[1] | |||
| H226, H301+H311+H331, P210, P280, P312, P301+P310, P302+P350 et P304+P340 |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le (cyclopentadiényl)cobalt dicarbonyle est un complexe organocobalteux de formule chimique (η5-C5H5)Co(CO)2, souvent abrégée CpCo(CO)2, où Cp représente le ligand cyclopentadiényle C5H5. Il s'agit d'un liquide rouge sombre qui se dégrade au contact de l'air et dont la molécule adopte une géométrie en tabouret de piano. Il est soluble dans les solvants organiques usuels[3].
Synthèse[modifier | modifier le code]
L'existence du (cyclopentadiényl)cobalt dicarbonyle a été publiée pour la première fois en 1954 par réaction d'octacarbonyle de dicobalt Co2(CO)8 avec du cyclopentadiène C5H6[4]. Cette même méthode est employée pour sa production industrielle :
On peut également le produire par carbonylation haute pression de cobaltocène (η5-C5H5)2Co à haute température :
- (η5-C5H5)2Co + 2 CO ⟶ (η5-C5H5)Co(CO)2 + « C5H5 ».
On identifie ce composé par ses pics d'absorption intenses à 2 030 et 1 960 cm−1 dans son spectre infrarouge[5].
Applications[modifier | modifier le code]
Le (cyclopentadiényl)cobalt dicarbonyle catalyse la cyclotrimérisation des alcynes (en)[6],[7]. Le cycle catalytique commence par la dissociation d'un ligand CO en formant un intermédiaire bis(alcyne)[8] :
Cette réaction fonctionne en formant des complexes métal–alcyne par dissociation des ligands CO. Bien que les complexes monoalcyne CpCo(CO)(R1C≡CR2) n'ont pas été isolés, leurs analogues à triphénylphosphine CpCo(Ph3P)(R1C≡CR2) sont obtenus à partir des réactions suivantes[8] :
CpCo(CO)2 catalyse la formation de pyridines à partir d'un mélange d'alcynes et de nitriles. La réduction de CpCo(CO)2 avec du sodium donne le radical dinucléaire [Cp2Co2(CO)2]−, qui réagit avec des halogénoalcanes pour donner des complexes de dialkyles [Cp2Co2(CO)2R2]. On obtient des cétones par carbonylation de ces complexes de dialkyle, ce qui régénère CpCo(CO)2[8].
Notes et références[modifier | modifier le code]
- « Fiche du composé Dicarbonylcyclopentadienylcobalt », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) R. B. King, F. G. A. Stone, William L. Jolly, Gordon Austin, William Covey, David Rabinovich, Henry Steinberg et Roy Tsugawa, « Cyclopentadienyl Metal Carbonyls and Some Derivatives », Inorganic Syntheses, vol. 7, (DOI 10.1002/9780470132388.ch31, lire en ligne)
- (en) T. S. Piper, F. A. Cotton et G. Wilkinson, « Cyclopentadienyl-carbon monoxide and related compounds of some transitional metals », Journal of Inorganic and Nuclear Chemistry, vol. 1, no 3, , p. 165-174 (DOI 10.1016/0022-1902(55)80053-X, lire en ligne)
- (en) « Cobalt, dicarbonyl(η5-2,4-cyclopentadien-1-yl)- », sur webbook.nist.gov, NIST (consulté le ).
- (en) K. Peter C. Vollhardt, « Cobalt-Mediated [2 + 2 + 2]-Cycloadditions: A Maturing Synthetic Strategy [New Synthetic Methods (43)] », Angewandte Chemie International Edition, vol. 23, no 8, , p. 539-556 (DOI 10.1002/anie.198405393, lire en ligne).
- (en) Tobias H. Staeb, Jorge Chávez, Rolf Gleiter et Bernhard Nuber, « The Role of [η2-Bis(tert-butylsulfonyl)acetylene](carbonyl)(η5-cyclopentadienyl)cobalt(I) as an Intermediate in the Alkyne Dimerisation », European Journal of Inorganic Chemistry, vol. 2005, no 20, , p. 4090-4093 (DOI 10.1002/ejic.200500394, lire en ligne)
- (en) Peter L. Pauson, Sandrine Ventre, Muriel Amatore, Corinne Aubert et Marc Petit, « Dicarbonyl(cyclopentadienyl)cobalt(I) », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rd078.pub2, lire en ligne)





