Télaprévir
| Télaprévir | |
| |
| Identification | |
|---|---|
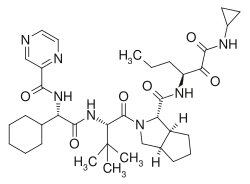
| Nom UICPA | (1S,3aR,6aS)-2-[(2Sv)-2-[[(2S)-2-cyclohexyl-2-(pyrazine-2-carbonylamino)acétyl]amino]-3,3-diméthylbutanoyl]-N-[(3S)-1-(cyclopropylamino)-1,2-dioxohexan-3-yl]-3,3a,4,5,6,6a-hexahydro-1H-cyclopenta[c] pyrrol-1-carboxamide |
| No CAS | |
| No ECHA | 100.129.857 |
| Code ATC | J05 |
| PubChem | 3010818 |
| Propriétés chimiques | |
| Formule | C36H53N7O6 [Isomères] |
| Masse molaire[1] | 679,849 3 ± 0,035 7 g/mol C 63,6 %, H 7,86 %, N 14,42 %, O 14,12 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le télaprévir est un inhibiteur de la protéase NS3/4A du virus de l'hépatite C de génotype 1 commercialisé en France sous le nom de Incivo par les laboratoires Janssen-Cilag depuis le [2].
Il est indiqué en association avec le peginterféron alfa et la ribavirine, chez le patient adulte ayant une maladie hépatique compensée (y compris ceux ayant une cirrhose) :
- soit naïfs de traitement ;
- soit ayant préalablement été traités par l'interféron alfa (pégylé ou non pégylé) seul ou en association avec la ribavirine, y compris les patients rechuteurs, répondeurs partiels et répondeurs nuls[3].
La trithérapie avec le télaprévir permet chez des malades ayant une hépatite C de génotype 1 et ne répondant pas à la bithérapie d’obtenir une guérison dans 75 % des cas contre 44 % chez ceux traités par bithérapie. Par ailleurs, la durée du traitement est raccourcie à 24 semaines (12 semaines de trithérapie suivie par 12 semaines de bithérapie) chez environ 2/3 des malades qui reçoivent le télaprévir quand le VHC est indétectable aux 4e et 12e semaines du traitement. Chez ces malades, le taux de guérison est voisin de 90 %. Chez les malades qui ont un virus détecté à la 4e semaine de traitement, la durée optimale du traitement est de 48 semaines (12 semaines de trithérapie suivies par 36 semaines de bithérapie) et le taux de guérison est d’environ 60 %. La trithérapie avec le télaprévir (12 semaines de trithérapie suivies par 36 semaines de bithérapie) permet d’obtenir une éradication du virus chez 60 % des malades en échec thérapeutique. Le taux de guérison dépend du type de la réponse virologique au traitement antérieur. Il passe de 31 % chez des malades ayant une réponse nulle (diminution de l’ARN du VHC <2 log à S12) à 86 % chez des malades répondeurs-rechuteurs.
La prise de télaprévir est associée à la survenue plus fréquente d’un prurit et d’une éruption cutanée que lors de la bithérapie. L'éruption cutanée est sévère chez environ 5 % des malades mais ne nécessite l’arrêt du traitement antiviral que chez 1 % des malades.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Date de l'autorisation de mise sur le marché (AMM) européenne centralisée
- [PDF] Fiche HAS,
- Cet article est partiellement ou en totalité issu de l'article intitulé « hépatite C » (voir la liste des auteurs).
