Géométrie moléculaire plane pentagonale
Apparence
| Géométrie moléculaire plane pentagonale | |
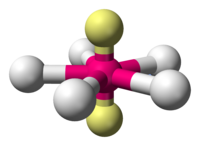
| |
| Notation VSEPR | AX5E2 |
|---|---|
| Exemple(s) | XeF5− |
| Symétrie moléculaire | D5h |
| Nombre stérique | 7 |
| Coordinence | 5 |
| Doublet non liant | 2 |
| μ (Polarité) | 0 |
| Angle de liaison | 72° |
| modifier |
|
En chimie, la géométrie moléculaire plane pentagonale décrit la forme de composés dans lesquels un atome central, noté A, est lié à cinq atomes, groupes d'atomes ou ligands, notés X, avec deux doublets non liants, notés E, sur l'atome central. Les cinq ligands définissent les sommets d'un pentagone. Cette configuration est notée AX5E2 selon la théorie VSEPR.

Exemples
[modifier | modifier le code]Les deux seules espèces planes pentagonales connues sont les ions isoélectroniques (électrons à neuf valences) XeF5− et IF52−[1].
Les deux sont dérivés de la géométrie moléculaire bipyramidale pentagonale avec deux doublets d'électrons non-liants occupant les positions apicales et les cinq atomes de fluor, tous équatoriaux.
Notes et références
[modifier | modifier le code]- C. E. Housecroft et A. G. Sharpe, Inorganic Chemistry, Prentice Hall, (ISBN 978-0130399137), p. 498
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pentagonal planar molecular geometry » (voir la liste des auteurs).
