Cyclopropanone
| Cyclopropanone | |
| |
| Identification | |
|---|---|
| Nom UICPA | cyclopropanone |
| No CAS | |
| PubChem | 138404 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C3H4O [Isomères] |
| Masse molaire[1] | 56,063 3 ± 0,003 g/mol C 64,27 %, H 7,19 %, O 28,54 %, |
| Propriétés physiques | |
| T° fusion | −90 °C[réf. nécessaire] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
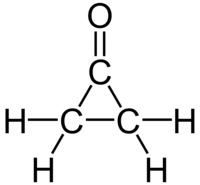
La cyclopropanone est un composé organique de formule brute C3H4O, constitué d'une structure carbonée de cyclopropane avec un groupe fonctionnel cétone. Très instable, elle est préparée par réaction du cétène avec du diazométhane à −145 °C[2],[3]. Les dérivés de la cyclopropanone présentent un intérêt certain en la chimie organique[4].
En synthèse organique, l'utilisation de la cyclopropanone est remplacée par celle de synthon tels que les acétals comme l'hémiacétal de l'éthylcyclopropanone[5] ou le triméthylsilylacétal d'éthylcyclopropanone[6].
Synthèse[modifier | modifier le code]
Le chimiste allemand Peter Lipp vers 1930 a l’idée de synthétiser la cyclopropanone à partir de cétène et de diazométhane. La réaction dans l'éther diéthylique conduit toutefois à la cyclobutanone. Il suppose donc que cela provient de la cétone sur un cycle à trois (la cyclopropanone), apparemment très réactive, qui agit comme produit intermédiaire. Lipp et ses collaborateurs ont ensuite pu isoler l'hydrate de cyclopropanone en ajoutant de l'eau, qui s'est toutefois rapidement isomérisée en acide propanoïque. Avec du méthanol ou de l'éthanol, ils obtiennent les hémiacétals de la cyclopropanone[7].

Ces travaux pionniers sont confirmés environ trois décennies plus tard avec des techniques de laboratoire avancées dans le groupe de travail néerlandais autour de T. J. deBoer. Lorsque le cétène et le diazométhane régissent dans du propane liquéfié ou dans un mélange trichlorofluorométhane/chloroforme à −78 °C, la cyclopropanone a été isolée et caractérisée[8]. Stockée à la température de l'azote liquide (environ −196 °C), la cyclopropanone s'est avérée stable. Lors du chauffage à 0 °C, un polymère s'est formé dans une réaction exothermique. Même en phase gazeuse, la polymérisation se produit à la surface du verre.

Aux États-Unis, Nicholas Turro (de) et W. B. Hammond explorent la chimie de la cyclopropanone et, surtout, de ses dérivés méthyliques à peu près au même moment[9],[10].
Finalement, H. A. McGee Jr et ses collaborateurs synthétisent la cyclopropanone à partir de réactifs liquides (cétène et diazométhane) à −145 °C par chimie cryogénique, et ainsi peuvent étudier le spectre de masse et la désintégration de la cétone[3].
Dérivé[modifier | modifier le code]
Les dérivés de la cyclopropanone sont des intermédiaires dans le réarrangement de Favorskii avec des cétones cycliques dans lesquelles la formation d’acides carboxyliques est accompagnée par une contraction cyclique.
Une caractéristique intéressante des cyclopropanones est qu'elles réagissent sous la forme de 1,3-dipôles dans des cycloadditions, par exemple avec des diènes cycliques tels que le furane[11],[12]. L'intermédiaire actif pourrait être un tautomère formé par scission de la liaison C2-C3 ou une structure biradicale, mais les expériences n'ont pas permis de le vérifier.
D'autres réactions sur les cyclopropanones se font en passant par cet intermédiaire. Par exemple, la (+)-trans-2,3-ditertbutylcyclopropanone énantiopure se racémise lorsqu'elle est chauffée à 80 °C[13].
Un intermédiaire oxyallyle est également suggéré dans la conversion photochimique de la 3,5-dihydro-4H-pyrazole-4-one avec élimination d'azote, pour former un indane[14] :
Dans cette réaction, l'intermédiaire oxyallyle A, en équilibre chimique avec la cyclopropanone B, subit une réaction intramoléculaire pour former le cyclohexa-1,3-diène C suivi d'une réaromatisation. La différence d'énergie entre A et B est de 5 à 7 kcal mol−1 (21 à 29 kJ mol−1).
Références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « cyclopropanone » (voir la liste des auteurs) et en allemand « cyclopropanon » (voir la liste des auteurs)..
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Preparation and characterization of cyclopropanone, methylcyclopropanone, 2,2-dimethylcyclopropanone and tetramethylcyclopropanone N. J. Turro and W. B. Hammond, Tetrahedron, Volume 24, Issue 18, 1968, Pages 6017-6028 DOI 10.1016/S0040-4020(01)90985-8
- E. F. Rothgery, R. J. Holt und H. A. McGee, Jr., Cryochemical Synthesis and Molecular Energies fo Cyclopropanone and Some Related Compounds, J. Amer. Chem. Soc., 1975, vol. 97(17), pp. 4971–4973. DOI 10.1021/ja00850a034.
- Cyclopropanones Nicholas J. Turro, Acc. Chem. Res.; 1969; 2(1); 25-32. DOI 10.1021/ar50013a004
- Synthèses organiques , Coll. Vol. 7, page 131 (1990); Vol. 63, p.147 ( 1985 ). [Lien http://www.orgsynth.org/orgsyn/pdfs/CV7P0131.pdf ]
- Fiche technique fournisseur commercial Lien
- P. Lipp, J. Buchkremer, H. Seeles, Studien in der Cyclopropan-Reihe. Cyclo-propanon, Justus Liebig's Annalen der Chemi, 1932, 499, pp. 1–25. DOI 10.1002/jlac.19324990102.
- S. E. Schaafsma, H. Steinberg, T. J. de Boer, The synthesis of cyclopropanone, Recueil des Travaux Chimiques des Pays-Bas, 1966, 85, pp. 1170–1172. DOI 10.1002/recl.19660851113.
- N.J. Turro, W.B. Hammond, Cyclopropanones—VIII, Tetrahedron, 1968, vol. 24, pp. 6017–6028. DOI 10.1016/S0040-4020(01)90985-8.
- Nicholas J. Turro, Cyclopropanones, Accounts of Chemical Research, 1969, vol. 2, pp. 25–32; DOI 10.1021/ar50013a004.
- Cyclopropanones. XII. Cycloaddition reactions of cyclopropanones Nicholas J. Turro, Simon S. Edelson, John R. Williams, Thomas R. Darling, Willis B. Hammond, J. Am. Chem. Soc.; 1969; 91(9); 2283-2292. DOI 10.1021/ja01037a018
- Cyclopropanones. XVII. Kinetics of the cycloaddition reaction of cyclopropanones with 1,3-dienes Simon S. Edelson, Nicholas J. Turro J. Am. Chem. Soc.; 1970; 92(9); 2770-2773. DOI 10.1021/ja00712a030
- Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone Frederick D. Greene, David B. Sclove, Jose F. Pazos, Ronald L. Camp J. Am. Chem. Soc.; 1970; 92(25); 7488-7488. DOI 10.1021/ja00728a051
- First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone Andrey G. Moiseev, Manabu Abe, Evgeny O. Danilov, and Douglas C. Neckers, J. Org. Chem.; 2007; 72(8) pp 2777 - 2784; (Article) DOI 10.1021/jo062259r
Voir aussi[modifier | modifier le code]
- Autres cétones cycliques : cyclobutanone , cyclopentanone , cyclohexanone
- Autres dérivés du cyclopropane : cyclopropène, cyclopropénone


