Cétyle


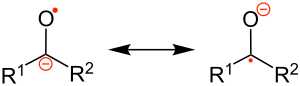
Un groupe cétyle est en chimie organique un anion radicalaire dans lequel un atome d'oxygène est lié à un atome de carbone, partageant un doublet libre et un électron libre[1] :
Sa formule générale est R2C−-O.. Ce radical est très instable et n'apparaît que comme intermédiaire réactionnel. Un groupe cétyle peut être formé par réduction monoélectronique d'un groupe carbonyle par un métal alcalin.
Les cétyles sont des intermédiaires impliqués dans la réaction de couplage du pinacol et la réaction de McMurry. Ils peuvent aussi servir de réactif pour détecter la présence de petites quantités d'eau, les solutions de molécules comportant un groupe cétyle ayant une couleur intense.
Des radicaux cétyles sont formés dans l'utilisation du sodium/benzophénone pour dessécher et désoxygéner un solvant : le sodium réduit la benzophénone en radical cétyle soluble qui réagit rapidement avec l'eau et le dioxygène dissous dans le solvant. Une couleur bleu foncé indique qualitativement que le solvant est sec et désoxygéné.
Notes et références[modifier | modifier le code]
- (en) « ketyls », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ketyl » (voir la liste des auteurs).