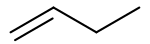
Butène
Le butène ou butylène a pour formule brute C4H8 et est donc un hydrocarbure alcénique. Butène désigne le plus souvent le but-1-ène mais correspond aussi à d'autres isomères :
- le but-1-ène ;
- le (Z)-but-2-ène ;
- le (E)-but-2-ène ;
- le 2-méthylprop-1-ène qui constitue une matière première pour la synthèse de l'isoprène.
Ces quatre isomères peuvent aussi être appelés :
- butène pour le but-1-ène ;
- (Z)-butène pour le (Z)-but-2-ène ;
- (E)-butène pour le (E)-but-2-ène ;
- isobutène pour le 2-méthylprop-1-ène
| nom IUPAC | nom courant | numéro CAS | structure | représentation topologique | modèle 3D |
| but-1-ène | α-butylène | 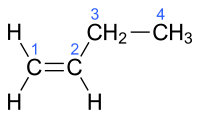 |
 | ||
| Z-but-2-ène | Z-β-butylène |  |
 |
 | |
| E-but-2-ène | E-β-butylène | 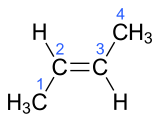 |
 |
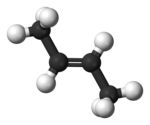 | |
| 2-méthylpropène | isobutylène |  |
 |
 |
Ces quatre hydrocarbures possèdent quatre atomes de carbone et une double liaison dans leur molécule, mais présentent des structures chimiques différentes visibles sur les schémas de leur structure. Les petits nombres mentionnés en bleu énumèrent les atomes de la chaîne carbonée principale. Il existe d'autres composés organiques de même formule brute qui ne sont pas des alcènes C4H8, (cyclobutane et méthylcyclopropane).
Ces quatre isomères sont des gaz dans les conditions de température et de pression normales. Ils peuvent être liquéfiés par une baisse de température ou une élévation de pression à l'image de ce qui se fait pour le butane. Ce sont des gaz incolores, que l'on ne peut pas caractériser par l'odeur, hautement inflammables.
Bien qu'ils ne soient pas présents à l'état naturel dans les produits pétroliers, on peut les obtenir des produits pétrochimiques par cracking du pétrole. Relativement stables, ils sont plus réactifs que les alcanes correspondants en raison de leur double liaison C=C. Le but-1-ène est un alcène à chaîne linéaire et l'isobutylène un alcène à chaîne ramifiée.
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « butene » (voir la liste des auteurs).