Gélose ADN-bleu de toluidine
La gélose à ADN au bleu de toluidine est utilisée pour déterminer la présence d'une activité nucléase chez un micro-organisme.
En routine, on l'utilise pour identifier l'expression d'une DNAse thermorésistante (ou thermonucléase TNase) caractéristique de l'espèce Staphylococcus aureus.
Usage[modifier | modifier le code]
Recherche de la DNAse thermorésistante de Staphylococcus (Microbiologie alimentaire et médicale)
Principe[modifier | modifier le code]
- Dans un premier temps élimination des nucléases thermolabiles par chauffage (notamment de Staphylococcus epidermidis et Micrococcus sp.)
- Métachromasie du bleu de toluidine vers le rouge/rose du fait de l'action de la TNase sur l'ADN du milieu (en présence de Ca++)
- Le bleu de toluidine colore les nucléotides en rose.
Composition[modifier | modifier le code]
Composition basé sur Les Milieux de culture de N. Marchal, J.L. Bourdon et Cl. Richard [1]
- Tampon TRIS pH 9 (0,05 M) .................................1000mL - ADN .......................................................0,3g - Solution de bleu de toluidine (0,1 M)......................3mL - Solution de chlorure de calcium (CaCl2) (0,01 M) ..........1mL - chlorure de sodium (NaCl)..................................10g - Agar-agar..................................................10g
(pH final = 8.6)
Préparation[modifier | modifier le code]
Milieu prêt à l'emploi. Il est possible de la fabriquer à partir des constituants de base.
Recherche de la DNAse thermostable ou Thermonucléase[modifier | modifier le code]
La DNAse thermostable est une enzyme qui résiste à la chaleur (100 °C pendant 15 minutes) et qui dégrade l'ADN selon la réaction :
Technique[modifier | modifier le code]
Ensemencer un bouillon cœur-cervelle pendant 24 heures à 37 °C, ou 3 à 4 heures sous agitations [1], avec la souche à étudier.
En placer, une partie 15 min au bain-marie (100 °C) et conserver le reste.
Percer la gélose de 3 trous. Inoculer quelques gouttes :
- De bouillon stérile dans le premier puits. (contrôle négatif)
- De bouillon chauffé, et refroidi, dans le second puits.
- De bouillon non chauffé dans le troisième. (facultatif - contrôle positif)
Incuber 4 heures à 37 °C.
Remarques : bien noter le contenu de chaque puits au dos de la boîte de Petri. Limiter à quelques gouttes de bouillon sans faire déborder les puits. Incuber la gélose sans retourner la boîte.
Lecture[modifier | modifier le code]
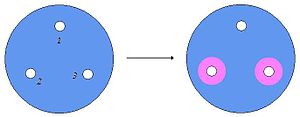
L'observation d'un éventuel halo rose de métachromasie signe la présence d'une DNAse autour des trous percés sur le fond bleu de la gélose.
- Puits témoin : contenant du bouillon cœur cervelle stérile
- Puits contenant du milieu cœur cervelle avec la souche à étudier
- Puits contenant du milieu cœur cervelle ensemencé puis chauffé a 100 °C pendant 10 minutes
- Si le puits 1 devient rose, le test est à recommencer.
- Si le puits 2 devient rose et que le puits 3 reste bleu, la souche possède une DNase non thermostable.
- Si les puits 2 et 3 sont roses, la souche possède une DNase thermostable (donc S. aureus si Coque Gram positif)
Limites[modifier | modifier le code]
- Présence de TNase chez S. hyicus, S. intermedius, S.lugdunensis et S. schleiferi
Alternative simplifiée[modifier | modifier le code]
Une autre méthode proposée par Diagnostics Pasteur peut également être utilisée[1]. Voici en quoi elle consiste :
- Sur Baird-Paker, après 24 h de culture (habituellement 48 h)
- Observer les boîtes à la recherche de colonies suspectes (colonies noires avec halo clair)
- Placer ces boîtes à 60 °C durant 2 heures et laisser refroidir
- Recouvrir le milieu Baird-Paker de milieu ADN-Toluidine en surfusion (~45 °C) et laisser prendre en masse.
- Incuber à 37 °C durant 3 à 4 heures
- Observer le résultat
Les zones de halos roses sont, ici également, caractéristiques d'une thermonucléase présente chez les bactéries des colonies suspectes.
Voir aussi[modifier | modifier le code]
Références[modifier | modifier le code]
- N. Marchal, J.L. Bourdon, Cl. Richard, Les Milieux de culture : pour l'isolement et l'identification biochimique des bactéries, Doin, , p. 185;192-193


