Phénylpropanoïde
Les phénylpropanoïdes sont une classe de composés organiques, dérivés de plantes, biosynthétisés à partir d'un acide aminé, la phénylalanine. Ils ont une grande variété de fonctions, comme la défense contre les herbivores, les attaques microbiennes et les autres agresseurs potentiels. Ils sont aussi composants des parois des cellules, servent de protection contre les ultraviolets, de pigments et de molécules de signal.

Acides cinnamiques
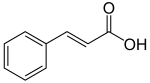
La phénylalanine est d'abord transformée en acide cinnamique par l'action de l'enzyme phénylalanine ammonia-lyase (PAL). Une série d'hydroxylations et de méthylations enzymatiques conduisent à l'acide paracoumarique, l'acide caféique, l'acide férulique, l'acide 5-hydroxyférulique et à l'acide sinapique. L'estérification de ces acides produit une partie des composés volatils qui composent le parfum des plantes et des fleurs. Ces esters, comme le cinnamate d'éthyle, ont de multiples fonctions, par exemple attirer les pollinisateurs.
Aldéhydes cinnamiques et monolignols
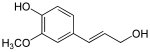
La réduction des fonctions acide carboxylique des acides cinnamiques produit les aldéhydes correspondants, comme l'aldéhyde cinnamique. Une autre série de réductions produit des monolignols, parmi lesquels l'alcool coumarylique, l'alcool coniférylique et l'alcool sinapylique. Les monolignols, monomères, sont polymérisés en différentes formes de lignines et subérines, composés principaux des parois cellulaires des plantes.

Les phénylpropènes, dont l'eugénol, le chavicol, le safrole ou l'estragol, sont aussi des dérivés des monolignols. Ces composés sont les premiers constituants d'un certain nombre d'huiles essentielles.
Coumarines et flavonoïdes

L'hydroxylation du 4e carbone du groupe phényle de l'acide cinnamique produit l'acide paracoumarique ainsi que par la suite d'autres dérivés hydroxylés. Ceux-ci peuvent alors subir une réaction intra-moléculaire, et produire des coumarines, par exemple l'ombelliférone.
L'acide p-coumarique, via son thioester avec la coenzyme A, c'est-à-dire la 4-coumaroyl-CoA, peut aussi être transformé en chalcone. Ceci se produit par l'addition de 3 molécules de malonyl-coenzyme A et leur cyclisation en second groupe phényle (voir polyphénol). La chalcone est un précurseur de tous les flavonoïdes, une classe de composés phytochimiques.
Stilbénoïdes

Les stilbénoïdes, comme le resvératrol, sont des dérivés hydroxylés du stilbène. Ils sont formés par d'autres cyclisations de la cinammoyl-CoA ou de la 4-coumaroyl-CoA.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phenylpropanoid » (voir la liste des auteurs).
Bibliographie
- (en) K Hahlbrock, D Scheel, « Physiology and Molecular Biology of Phenylpropanoid Metabolism », Annual Review of Plant Physiology and Plant Molecular Biology, vol. 40, , p. 347–69 (DOI 10.1146/annurev.pp.40.060189.002023, lire en ligne)
