Biuret
| Biuret | |
 |
|
| Identification | |
|---|---|
| Nom UICPA | Carbamoylurée |
| Synonymes |
2-imidodicarbonyl diamide, carbamylurée, imidodicarbonyl diamide, allophanamide |
| No CAS | |
| No ECHA | 100.003.236 |
| No CE | 203-559-0 |
| SMILES | |
| Propriétés chimiques | |
| Formule | C2H5N3O2 [Isomères] |
| Masse molaire[1] | 103,08 ± 0,003 2 g/mol C 23,3 %, H 4,89 %, N 40,76 %, O 31,04 %, |
| Propriétés physiques | |
| T° fusion | 186 à 189 °C (se décompose) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
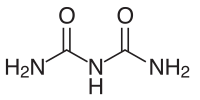
Le biuret est un composé organique obtenu par condensation de deux molécules d'urée et élimination d'une molécule d'ammoniac. Dans les conditions normales de température et de pression, il se présente sous la forme d'un solide blanc, soluble dans l'eau chaude et se décomposant de 186 à 189 °C.
Synthèse
Le composé peut être préparé en chauffant l'urée au-delà de son point de fusion, à laquelle température l'ammoniac est éliminé.
- 2 CO(NH2)2 → H2N-CO-NH-CO-NH2 +NH3 ↑
Cette réaction apparaît lors de la phase de concentration et de cristallisation lors de la production industrielle de l'urée comme engrais. Le biuret étant un toxique pour les végétaux, sa teneur dans les engrais azotés doit être inférieure à 1,2 % selon la norme NF U42-001.
Dérivés
Par métonymie, on appelle également « biuret » le groupe fonctionnel RHN-CO-NR-CO-NHR et la classe de composés organiques qui en dérivent. Les biurets peuvent être préparés par trimérisation d'isocyanates : par exemple, le biuret du diisocyanate d'hexaméthylène est également connu comme HDI-biuret.
Le test au biuret permet de mettre en évidence et/ou de titrer les protéines. Celles-ci réagissent, à l'instar des biurets, en formant un complexe coloré avec les ions cuivre(II).
Voir aussi
Articles connexes
Liens externes
Fiches de données de sécurité :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
