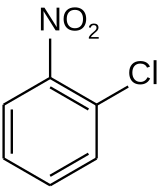
2-Chloronitrobenzène
| 2-Nitrochlorobenzène | |
| |
| Identification | |
|---|---|
| Nom UICPA | 1-chloro-2-nitrobenzene |
| Synonymes |
ortho-nitrochlorobenzène |
| No CAS | |
| No ECHA | 100.001.686 |
| No CE | 201-854-9 |
| No RTECS | CZ0875000 |
| PubChem | |
| ChEBI | 34270 |
| SMILES | |
| InChI | |
| Apparence | cristaux jaunes à l'odeur caractéristique |
| Propriétés chimiques | |
| Formule | C6H4ClNO2 [Isomères] |
| Masse molaire[1] | 157,554 ± 0,008 g/mol C 45,74 %, H 2,56 %, Cl 22,5 %, N 8,89 %, O 20,31 %, |
| Propriétés physiques | |
| T° fusion | 33 °C |
| T° ébullition | 245.5 °C |
| Masse volumique | 1,368 g·mL−1 |
| T° d'auto-inflammation | 470 °C |
| Point d’éclair | 124 °C |
| Pression de vapeur saturante | 0,6 kPa (20 °C) |
| Précautions | |
| SGH | |
| H301, H302, H311, H312, H317, H331, H332, H350, H351, H361, H372, H411, P280, P310 et P312 |
|
| NFPA 704 | |
| Écotoxicologie | |
| DL50 | 1 320 mg·kg−1 (rat mâle) |
| LogP | 2,24 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le 2-chloronitrobenzène, 1-chloro-2-nitrobenzène ou orthochloronitrobenzène est un composé aromatique de formule C6H4ClNO2. C'est l'un des trois isomères du chloronitrobenzène, dont il est issu, le composé ortho, et est donc constitué d'un cycle de benzène substitué par un groupe nitro et un atome de chlore.
Il est utilisé comme matière première pour la synthèse de certains colorants et intermédiaires pour l'industrie pharmaceutique.
Propriétés physiques
[modifier | modifier le code]Le 2-nitrochlorobenzène forme, dans des conditions normales, des cristaux monocliniques en forme d'aiguilles, de couleur jaune à jaune clair. Sa densité relative est de 1,305. Le 2-nitrochlorobenzène pur fond à 32 ° C, mais s'il se mélange avec l'isomère 4-chloronitrobenzène, alors son point de fusion chute de 0,5 ° C, pour seulement 1% de la concentration totale. Le mélange d'isomères contenant 66,9% de 4-chloronitrobenzène et 33,1% de 2-chloronitrobenzène forme un eutectique avec un point de fusion de 14,65 ° C. Le point d'ébullition du 2-nitrochlorobenzène à pression normale est de 245,5 ° C, à 8 mmHg.
Ce composé est pratiquement insoluble dans l'eau, très bien soluble dans l'acétone, la pyridine, mais aussi dans le toluène, le méthanol, le tétrachlorure de carbone, l'éther diéthylique, le benzène, l'éthanol et le chlorobenzène.
Réactivité
[modifier | modifier le code]La présence d'un groupe nitro dans le noyau benzénique facilite les réactions de substitution nucléophile, mais pas au point que, par exemple, il soit facile de remplacer un atome de chlore par une solution aqueuse alcaline à pression normale. Dans des conditions plus sévères, la réaction continue avec la formation de 2-nitrophénol :

Lorsque le 2-chloronitrobenzène interagit avec 80-90% de méthanol aqueux à 95-110 ° C, pendant 4 à 8 heures, en présence d'air ou d'oxygène et d'alcali, on obtient du 2-nitroanisole :

A partir du 2-chloronitrobenzène, la 2-nitroaniline est obtenue par chauffage à 170-200 ° C avec une solution aqueuse d'ammoniaque à 30-34% à une pression de 30-40 atm :

Lors de la réduction avec des copeaux de fonte en présence de chlorure ferrique, il se forme de la 2-chloroaniline :

Lorsqu'il est réduit avec de la poussière de zinc en milieu alcalin, on obtient du 2,2'-dichlorohydrabenzène :

Lorsque le 2-chloronitrobenzène interagit avec le disulfure de sodium, il se forme du disulfure de 2,2'-nitrodiphényle, qui est utilisé pour la synthèse de l'acide orthanilique :

Lors de sa sulfonation, il se forme de l’acide 3-nitro-4-chlorobenzènesulfonique :

De même, lors de sa sulfochloration, il se forme du 3-nitro-4-chlorobenzènesulfochlorure :

Détection
[modifier | modifier le code]Le 2-chloronitrobenzène est détecté en réduisant le groupe nitro en groupe amino, suivi d'une diazotation. La poussière de zinc peut être utilisée comme agent réducteur et le papier amidon iodé comme indicateur. Il existe également une méthode de dosage du 2-nitrochlorobenzène par chromatographie en phase gazeuse.
Synthèse
[modifier | modifier le code]Obtention en laboratoire
[modifier | modifier le code]En laboratoire, le composé peut être obtenu par nitration du chlorobenzène avec du nitrate d'acétyle. Dans ce cas, cependant, non seulement on obtient du 2-nitrochlorobenzène, mais également ses isomères :

Il existe également un moyen de le préparer à partir de 2-nitroaniline :

Production industrielle
[modifier | modifier le code]Dans l'industrie, le 2-chloronitrobenzène est également obtenu par nitration du chlorobenzène avec formation d'un mélange d'isomères contenant 60 à 63% de 4-chloronitrobenzène, 37 à 40% de 2-chloronitrobenzène et des traces de 3-chloronitrobenzène. Toutefois, des mélanges de nitrés ou des mélanges de nitrates de métaux alcalins sont utilisés pour la nitration avec l'acide sulfurique. La nitration est effectuée à 20-35 ° C, en ajoutant le mélange de nitrant en petites proportions. À des températures trop basses, l'acide nitrique se formerait dans des quantités dangereuses ; et à des températures trop élevées, la formation d'un produit non cible, le 2,4-dinitrochlorobenzène, risquerait de perturber la réaction. Après avoir ajouté tout le mélange nitrant sous agitation constante, la température est portée à 45 ° C. Le mélange d'isomères résultant est d'abord purifié puis séparé du reste de la masse, et enfin il est neutralisé avec une solution de carbonate de sodium à 5-10%.
Le 2-chloronitrobenzène et le 4-chloronitrobenzène sont difficiles à séparer par cristallisation et rectification. Lors du refroidissement du mélange à 16 ° C et de la filtration ultérieure, plus de la moitié du 4-nitrochlorobenzène ne peut être isolée. Pour une séparation plus complète après filtration, le mélange est soumis à un fractionnement dans une colonne de rectification . Les isomères du chloronitrobenzène peuvent également être séparés par nitration d'un mélange d'isomères à 60-100 ° C, le 2-chloronitrobenzène étant converti en 2,4-dinitrochlorobenzène et le 4-chlonitrorobenzène faiblement nitré .
Application
[modifier | modifier le code]Ce composé est par ailleurs utilisé comme matière première pour la synthèse de certains colorants et intermédiaires pour l'industrie pharmaceutique. En particulier, il permet de fabriquer la 2-chlorobenzidine, le 2-nitroanisole, la 2-phénylènediamine, la 4,6-dichloro-2-nitroaniline et le 2-aminoanisole. De plus, il est en usage dans la production de diazols, de colorants dispersés et de pigments. Il est également utilisé en tant qu'agent anti-voile en photographie.
Toxicité
[modifier | modifier le code]Le 2-chloronitrobenzène est une substance de la deuxième classe de danger, la limite de concentration maximale dans l'air étant de 1 mg/m3. C'est aussi une hémotoxine et neurotoxine forte. L'effet toxique est similaire au nitrobenzène car il peut, par exemple, provoquer une toxidermie. En cas d'inhalation ou d'ingestion, il rend les lèvres, les ongles et la peau bleus, provoque des maux de tête, des étourdissements, des nausées, des convulsions ainsi qu'une perte de conscience conduisant éventuellement à la mort.
Aucune donnée fiable sur sa cancérogénicité n'a cependant été trouvée.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.





