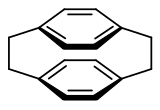
(2,2)Paracyclophane
| [2,2]Paracyclophane | |
| |
| Identification | |
|---|---|
| Nom UICPA | tricyclo[8.2.2.24,7]hexadeca-1(13),4,6,10(14),11,15-hexaene [1] |
| Nom systématique | [2.2]paracyclophane |
| Synonymes |
[2.2](1,4)Cyclophane, 1,4-Carbophane, Cyclobis(benzene-1,4-dimethylene), Parylene dimer, Di-p-xylylene [1] |
| No CAS | 1633-22-3 [1] |
| No ECHA | 100.015.132 [1] |
| PubChem | 74210 [1] |
| SMILES | |
| Apparence | Poudre blanche [2] |
| Propriétés chimiques | |
| Formule | C16H16 [Isomères] |
| Masse molaire[3] | 208,298 2 ± 0,013 9 g/mol C 92,26 %, H 7,74 %, 208.304 g/mol [1] |
| Propriétés physiques | |
| T° fusion | 285-288 °C [4] |
| T° ébullition | 285 °C |
| Solubilité | Soluble dans le toluène ; insoluble dans l'eau [2] |
| Masse volumique | 1.0102 g/cm3 [2] |
| Précautions | |
| SGH | |
| H317, H373, P260, P261, P272, P280, P321, P302+P352 et P501 [1] |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le [2,2]paracyclophane est un composé organique de formule brute C16H16 de la famille des cyclophanes, dont il est considéré comme le plus petit membre[5]. Cette famille regroupe les composés possédant deux groupes p-phénylène se faisant face, liés par des ponts alkyle. Ils sont très utilisés en chimie organique car ils adoptent des conformations inhabituelles du fait des tensions de cycle.
Au cours des dernières années, la chimie du [2,2]paracyclophane a fait des progrès considérables, ce qui a permis d'affiner ses propriétés structurales et fonctionnelles[5]. Les dérivés du paracyclophane sont obtenus grâce aux interactions entre les deux systèmes π conjugués qui sont face à face. Les dérivés de ce composé trouvent plusieurs applications dans différents domaines de la chimie tels que la catalyse organométallique, la synthèse asymétrique et la chimie des matériaux.
Actuellement, le [2,2]paracyclophane est largement utilisé comme monomère dans l'industrie pour produire du parylène à grande échelle.
Contexte historique[modifier | modifier le code]
Le [2,2]paracyclophane a été découvert par hasard par Brown et Farthing en 1949 comme sous-produit par la pyrolyse en phase gazeuse du paraxylène à basse pression[6] :

Cependant, c’est en 1951 que la première synthèse de ce composé a été reportée par Cram et Steinberg. L’utilisation industrielle de ce composé et de ses dérivés est due au procédé de Gorham qui permet de créer un dépôt chimique en phase vapeur pour produire des revêtements de surface polymères[7], appelés parylènes.
Structure, propriétés et réactivité[modifier | modifier le code]
Le [2,2]paracyclophane est constitué de deux cycles benzéniques empilés de manière co-faciale, l’un par rapport à l’autre, et reliés entre eux par deux ponts éthylène en position para. Les longueurs des liaisons C-C du [2,2]paracyclophane sont légèrement plus grandes que celles des liaisons classiques, 1,63 Å contre 1,54[8]. L'analyse cristallographique aux rayons X réalisée par Trueblood et Al en 1972 a révélé que les deux anneaux phényles adoptent une conformation inhabituelle en forme de bateau. Pendant de nombreuses années, on a supposé que le [2,2]paracyclophane présentait une conformation totalement éclipsée avec une symétrie moléculaire D2h[5]. Cependant, des études expérimentales et théoriques plus récentes suggèrent qu’à très basse température le [2,2]paracyclophane peut adopter une conformation décalée de symétrie D2, avec un angle de torsion entre 6 et 9°. Ainsi, le [2,2]paracyclophane de symétrie D2h est maintenant considéré comme un état intermédiaire entre les deux conformères énantiomères du [2,2]paracyclophane de symétrie D2.

Le [2,2]paracyclophane possède 4 sites de substitution possibles sur chaque cycle soit 8 au total. La substitution d’un des cycles entraîne systématiquement la formation de composés chiraux planaires. En présence de plus d'un groupe fonctionnel, des molécules chirales complexes peuvent facilement être formées. Ces dérivés sont généralement décrits en tenant compte de leurs positions de substitution: les composés en ortho-, méta- et para-substitués présentent deux groupes fonctionnels différents sur le même cycle aromatique du noyau [2,2]paracyclophane, tandis que les composés pseudo-gem, pseudo-ortho, pseudo-meta ou pseudo-para peuvent être obtenus lorsque les substituants sont situés sur les deux cycles [2,2]paracyclophane[7].

Propriétés physico-chimiques[modifier | modifier le code]
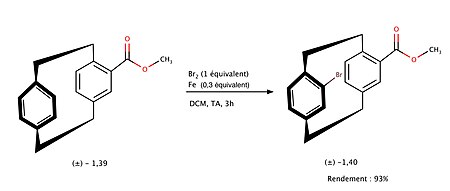
La fonctionnalisation des [2,2]paracyclophane peut fortement modifier la réactivité et les propriétés physico-chimiques de ces composés. L’ajout de substituants sur un des cycles aromatiques modifie en effet la répartition de la densité électronique qui peut désactiver ou activer certaines positions de l’autre cycle benzénique[9]. Par exemple pour le [2,2]paracyclophane, le groupe ester peut activer et permettre la fonctionnalisation sélective de la position pseudo-gem lors de la réaction de bromation[8] :
De plus, la tension conformationnelle du [2,2]paracyclophane a un impact sur la conjugaison des systèmes π et, par conséquent, sur la réactivité de ses unités aromatiques[10]. La structure déformée et empilée du cyclophane présent dans le [2,2]paracyclophane est utilisé pour maintenir deux chromophores à proximité [11]. En attachant des chromophores aux ponts éthylène du [2,2]paracyclophane, des systèmes π conjugués sont produits permettant l’amélioration du transfert de charge interne (TCI) ce qui engendre des propriétés photophysiques variées.

Fluorescence[modifier | modifier le code]
Le [2,2]paracyclophane présente un spectre d’émission de fluorescence avec une bande large à 356 nm. Certains fluorophores organiques issus du [2,2]paracyclophane possèdent des propriétés chiroptiques[10]. Ainsi, l’introduction de groupements tels que le brome sur un de ses groupements cyclophanes permet de concevoir des émetteurs luminescents à polarisation circulaire (CPL)[12].
Cependant, le rendement quantique de fluorescence est rarement bon. Les pertes radiatives, liées à l’interconversion entre les conformères du [2,2]paracyclophane, rendent les fluorophores qui en dérivent peu efficaces en termes de rendement quantique et compliquent leur utilisation dans d’autres domaines de la science[10].
Chiralité[modifier | modifier le code]

La première preuve expérimentale de la chiralité inhérente des [2,2]paracyclophanes fonctionnalisés a été apportée par Cram et Allinger en 1955 grâce à une cristallisation diastéréosélective des sels de brucine du 4-carboxy[2,2]paracyclophane[10].
La molécule de [2,2]paracyclophane non substituée est une molécule achirale. Cependant, une fois substituée, la molécule peut présenter une chiralité du fait de sa structure rigide empêchant tout mouvement de rotation des deux motifs aryle. Afin d’attribuer la configuration absolue Rp ou Sp (p designant la chiralité planaire) on applique les règles de Cahn, Ingold et Prelog. Le cycle aromatique du [2,2]paracyclophane est considéré comme le plan chiral sur lequel sont les atomes prioritaires. L’atome de carbone 1 est dit « atome pilote », et l’atome de carbone 2 est nommé « atome prioritaire »[5]. Le paracyclophane doit alors être dessiné de la manière suivante : le cycle aromatique le moins substitué devant, le plan chiral en arrière[5].
On distingue 2 méthodes de séparation des racémiques : la séparation classique, plus courante et plus simple, et la séparation cinétique, plus efficace et moins coûteuse grâce à l’utilisation de catalyseurs chiraux[10].
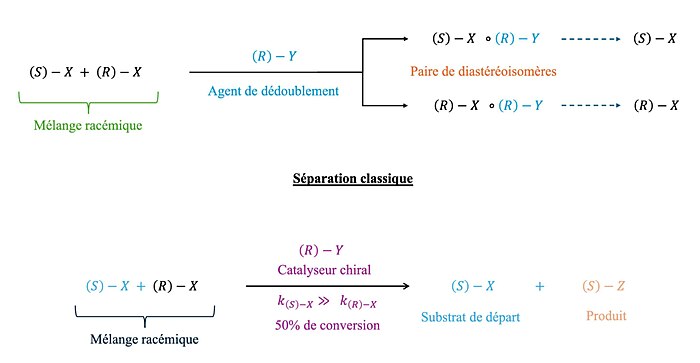
Cependant les deux méthodes ne pouvant atteindre que 50% de rendement maximum puisque l’on sépare un mélange initialement racémique, on privilégie une autre méthode, la séparation par désymétrisation, pouvant atteindre 100% de rendement théorique. C’est cette méthode qui a permis de procéder à l’isolation de [2,2]paracyclophane énantiopurs.

Synthèse[modifier | modifier le code]
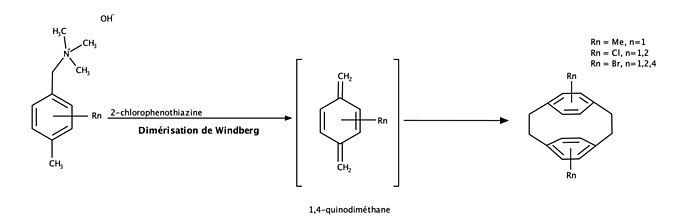
Le [2,2]paracyclophane et certains de ses dérivés peuvent être synthétisés par la dimérisation de Winberg[7],[13]. Des recherches ont pu démontrer que les dérivés du xylène peuvent être sélectivement dimérisés en dérivés du [2,2]paracyclophane (Chow, H.-F.; Low, K.-H.; Wong, K. Y. Synlett 2005, 2130 [13]). Cette réaction passe par la formation d'une structure intermédiaire de 1,4-quinodiméthane.
Le [2,2]paracyclophane peut aussi être synthétisé par dégradation de Hofmann[14] : la décomposition de l'hydroxyde de méthylbenzyltriméthylammonium[13] se produit à 60-100° sous pression réduite et donne, du poly-p-xylylène[14] et une petite quantité de [2,2]paracyclophane[8]. On peut facilement extraire le [2,2]paracyclophane à l'aide de toluène chaud[14].

Il a été observé que l'introduction d'un inhibiteur de polymérisation avant la décomposition de l'hydroxyde de méthylbenzyltriméthylammonium semble accroître la production du composé 8, permettant ainsi d'isoler le [2,2]paracyclophane avec un rendement de 17 %[14].
Étant donné la large disponibilité actuelle des halogénures de p-méthylbenzyltriméthylammonium, cette méthode représente une approche simple et pratique pour la synthèse du [2,2]paracyclophane[14].
Applications[modifier | modifier le code]
Le [2,2]paracyclophane est principalement étudié pour ses propriétés structurales et son comportement en chimie organique. En effet, la molécule peut être utilisée dans la conception de composés organiques plus complexes, telle que la conception de ligands pour la catalyse.
Application en catalyse asymétrique[modifier | modifier le code]
Lors d'une synthèse asymétrique le [2,2]paracyclophane passera d’un composé achiral à un composé chiral. On peut citer par exemple l’ajout de réactifs organozinciques aux composés carbonylés[13] mais également l’application des [2,2]paracyclophanes dérivés du phosphine[13]. L’alkylation allylique est apparue comme un outil très puissant dans la synthèse asymétrique et permet la stéréosélectivité de composés chiraux insaturés. On peut également citer d'éventuelles utilisations dans des réactions d'hydrogénation, de formation de liaisons C-C et C-X catalysées par des métaux de transition, l'utilisation de phosphines planaires-chirales, les carbènes planaires-chiraux, les [2,2]paracyclophanes en organocatalyse[pas clair][13].
Applications biologiques[modifier | modifier le code]
Les ARN sont considérés comme des cibles thérapeutiques importantes pour le développement de nouvelles techniques de ciblage moléculaire. Le [2,2]paracyclophane peut être utilisé comme base pour le développement de nouveaux ligands des acides ribonucléiques et permettre la conception de molécules permettant des interactions sélectives avec des ARN[8].
Les molécules aromatiques comme le [2,2]paracyclophane peuvent se lier aux bases hétéroaromatiques des nucléotides par des interactions π avec les bases non appariées des acides nucléiques via ses cycles benzéniques.[pas clair] Les interactions de cette molécule avec l’ARN peuvent être suivies grâce à ses propriétés de fluorescence. En outre, les divers sites de modification du [2,2]paracyclophane, caractérisés par leur nombre, leur nature et leurs orientations multiples, en font une molécule privilégiée pour l'introduction à la fois de diversité chimique et spatiale[5].
Notes et références[modifier | modifier le code]
- « (2.2)Paracyclophane ». In Wikipedia, 13 janvier 2024. https://en.wikipedia.org/w/index.php?title=(2.2)Paracyclophane&oldid=1195269588.
- « [2.2]Paracyclophane ». Consulté le 6 avril 2024. https://www.chembk.com/en/chem/[2.2]Paracyclophane.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- VWR. « [2.2]-Paracyclophane 99% ». Consulté le 6 avril 2024. https://fr.vwr.com/store/product/22676406/2-2-paracyclophane-99.
- « Benedetti-HD-sduzzk.pdf ». Consulté le 7 mars 2024. https://new.societechimiquedefrance.fr/wp-content/uploads/woocommerce_uploads/2024/01/Benedetti-HD-sduzzk.pdf.
- Hassan, Zahid, Eduard Spuling, Daniel M. Knoll, et Stefan Bräse, « Regioselective Functionalization of [2.2]Paracyclophanes: Recent Synthetic Progress and Perspectives », Angewandte Chemie International Edition, vol. 59, no 6, , p. 2156‑70 (DOI 10.1002/anie.201904863)
- (en) Hicks, Craig., The Synthesis and Applications of [2.2]Paracyclophane Derivatives
- Delcourt, Marie-Léonie. « Conception et évaluation de fragments paracyclophane pour la recherche de ligands spécifiques de structures tridimensionnelles de l’ARN ». These de doctorat, Sorbonne Paris Cité, 2018. https://www.theses.fr/2018USPCB047.
- Felder, Simon, Shiqi Wu, Jules Brom, Laurent Micouin, et Erica Benedetti., « Enantiopure Planar Chiral [2.2]Paracyclophanes: Synthesis and Applications in Asymmetric Organocatalysis », Chirality, vol. 33, no 9, , p. 506‑27 (DOI 10.1002/chir.23335)
- Felder, Simon. « Synthèse et caractérisation de nouveaux dérivés du [2.2]paracyclophane pour la conception de ligands spécifiques et sélectifs de structures tridimensionnelles de l’ARN ». Phdthesis, Université Paris Cité, 2022. https://theses.hal.science/tel-04004286.
- Elacqua, Elizabeth, Dejan-Krešimir Bučar, Yulia Skvortsova, Jonas Baltrusaitis, M. Lei Geng, et Leonard R. MacGillivray, « Dramatic Red-Shifted Fluorescence of [2.2]Paracyclophanes with Peripheral Substituents Attached to the Saturated Bridges », Organic Letters, vol. 11, no 22, , p. 5106‑9 (DOI 10.1021/ol901907j)
- Sugiura, Ken-ichi, « [2.2]Paracyclophane-Based Chiral Platforms for Circularly Polarized Luminescence Fluorophores and Their Chiroptical Properties: Past and Future », Frontiers in Chemistry, vol. 8, (DOI 10.3389/fchem.2020.00700)
- Paradies, Jan. « [2.2]Paracyclophane Derivatives: Synthesis and Application in Catalysis ». Synthesis 2011, nᵒ 23 (décembre 2011): 3749‑66. https://doi.org/10.1055/s-0031-1289296.
- Winberg, H. E., F. S. Fawcett, W. E. Mochel, et C. W. Theobald. « Dimethylenedihydroheteroaromatic Compounds and Heterocyclophanes by 1,6-Hofmann Elimination Reactions ». Journal of the American Chemical Society 82, nᵒ 6 (1 mars 1960): 1428‑35. https://doi.org/10.1021/ja01491a037.


